通过打破孤岛来提高分析生产力(第二部分)
对于与合同实验室合作的生物制药组织来说,重要的是要考虑如何转移数据和方法,以及如何管理生成的数据,使其符合数据完整性和合规性要求。

对于与合同实验室合作的生物制药组织来说,重要的是要考虑如何转移数据和方法,以及如何管理生成的数据,使其符合数据完整性和合规性要求。

我们倾听并了解了科学家们是如何分离mAbs和ADC的;然后我们设计了一种用于LC-MS生物分离的新型色谱柱。 1988年,单克隆抗体(mAb)作为生物治疗药物的大量和成功使用迈出了关键一步,当时引入了使这些生物分子人性化的技术,消除或减少了以前对病人的有害副作用。
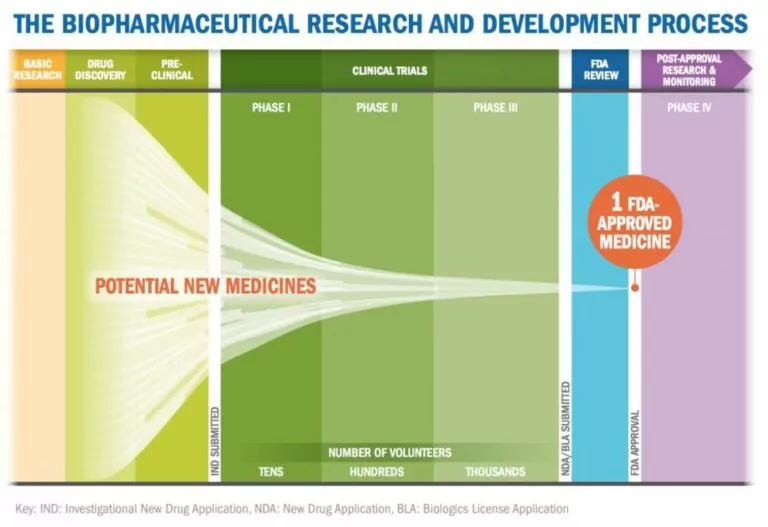
分析方法的转移。数据完整性。不断变化且更加严格的监管环境。所有这些,甚至更多,都影响着上游和下游生物制药过程中的生产力。沃特世如何帮助解决生物制品和生物仿制药的开发挑战?

在生物制品开发和质量控制中,有两种主要的多属性监测(MAM)检测选择:亚单位蛋白质量分析和LC-MS的肽图。在此,我们探讨肽图LC-MS MAM工作流程是如何被使用的。

在一个复杂的生物治疗药物开发项目中,成千上万的小延误和出错的机会会像滚雪球一样越滚越大。它们加起来就是时间的损失和风险的增加,而对这两种情况的容忍度都很低。其实不一定是这样的。

为了最大限度地利用最近在生物制药开发和质量控制方面的创新,如多属性监测,现在是时候更好地连接管理生物制药数据的系统了。本系列探讨了更好的生物制药数据的内容、原因和方法。
在生物治疗药物中,糖基化状态对分子的结构、稳定性、血清半衰期、免疫性和生物活性有着直接和明显的影响,并构成了一个关键的质量属性(CQA)。在我们的研究中,描述和比较英夫利昔单抗的糖基化特征,首先是检查来自完整的和减少的亚单位质量数据的糖基化特征。

高分辨率分析在创新药和生物仿制药表征方面的进展 第二部分:英夫利西单抗的肽分析

高分辨率分析在创新药和生物仿制药表征方面的进展 随着制药业继续将其重点从小分子药物发展到包括蛋白质疗法在内的平衡产品组合,分析化学家越来越多地面临着产生常规和自动化表征工作流程的挑战,以推动创新药和生物仿制药产品的开发和发展。
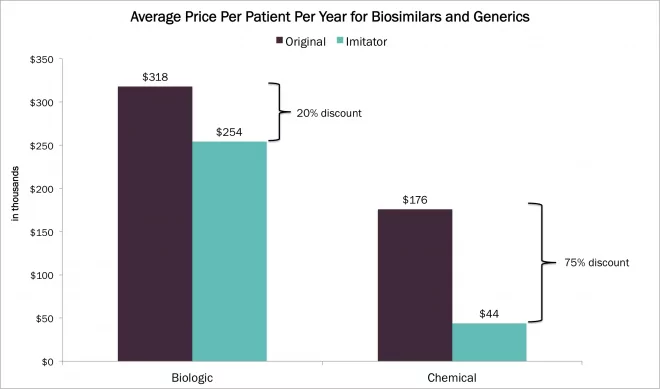
Waters生物制药业务发展总监Ken Fountain最近完成了一次颇有见地的亚洲之行,他拜访了Waters在韩国的客户,并出席了在上海举行的中国生物制药高管峰会,Waters是这次峰会的赞助商。我们采访了他,请他分享他对生物制药的看法。

随着监管机构对生物治疗药物的关键质量属性的关注,处于开发后期或质量控制的生物制药实验室可以做些什么来增加对其生物分离的信心--除了运行更多的检测之外?