保留或不保留?多少是足够的保留?

在我们在Waters发表的关于高极性农药(如草甘膦或矮壮素)的各种抵押品中,我们讨论的主要参数之一是保留。但我们所说的保留是什么意思呢?
- 保留时间(RT)是指从开始进样到出现分析物1的最大峰之间的时间。
然而,我们需要知道分析物与固定相材料有多少相互作用(它与固定相与流动相相互作用的相对时间)。
- 保留因子(k),以前被称为容量因子,是衡量目标分析物在固定相中停留的时间与它在流动相中停留的时间的关系1。
如果这种相互作用太短,那么就没有/很少发生色谱作用,分离将不太稳定,在使用LC-MS时将有很大机会出现离子抑制。
- 柱子的空隙体积(v)是对填充有固定相颗粒的柱子内部体积的测量,可以通过柱子的长度(L)和内径(ID)来估计。
- 柱子空隙体积(微升)= 0.66 x π x (柱子内径/2)2 x L
对于大多数用完全多孔的颗粒填充的Waters柱来说,可以使用0.66的 "孔隙体积 "值。表面多孔的颗粒(如固体核心),其体积较小,所以通常使用0.49的数值。
例如,对于3.0 mm x 100 mm的ACQUITY HSS T3柱,v = 0.467 mL
知道了柱子的空隙体积和使用的流速,就可以计算出柱子的空隙时间(t0)。
t0 = V/F
一个更准确的答案是通过测量你的柱子安装在LC系统中时的空隙体积,注入你知道的未被保留的化合物来找到。
以上是使用典型的多残留反相、液相色谱(LC)条件保留相对极性农药甲胺磷的例子。
分析质量控制、性能和方法验证指南,如SANTE/12682/20192和委员会决定2002/657/EC3指出 "被分析物的最小可接受保留时间应至少是与色谱柱空隙体积相应的保留时间的两倍"。
在上面的例子中,你可以看到所使用的色谱柱和LC条件为甲胺磷提供了足够的保留,符合SANTE指南。
如果我们还看一下保留因子(k),即衡量一个柱子的保留与柱子空闲时间(t0)的关系。
k = (tR - t0)/ t0
确保最早的洗脱峰的k值>1.0,最好>1.5。
当人们面对更多的极性分析物,如离子型极性农药时,无论选择哪种色谱系统,同样的规则都适用。使用典型的反相工作流程为这类化合物提供足够的保留是非常不可能的。
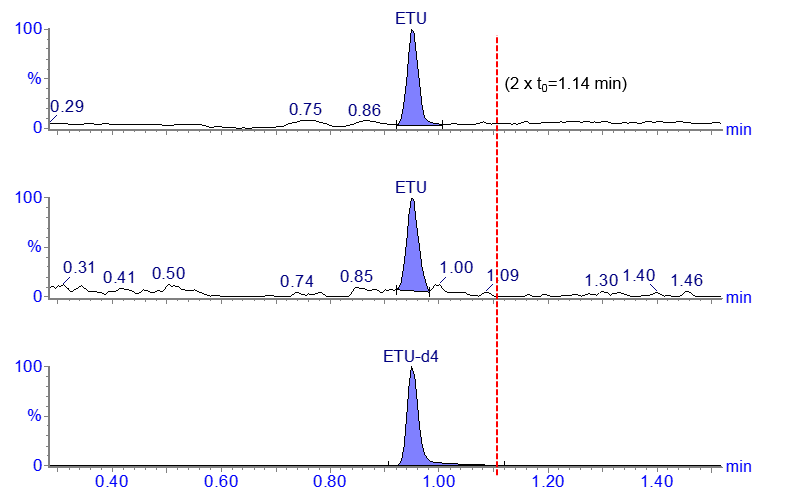
下面的色谱图显示了一种高度极性的化合物,乙烯硫脲(ETU)的LC-MS/MS分析。
这是一个早期方法开发的例子,色谱图来自HILIC柱(2.1 x 50 mm,1.7 µm),流速为0.2 mL/min。
- 这根2.1 x 50毫米的柱子的空隙体积是0.114毫升。
- 流速为0.2毫升/分钟,所以t0为0.57分钟(2 x t0=1 .14分钟)。
在这种情况下,在所使用的流动相条件下,ETU的保留时间小于两倍的柱空时间(t0)。
保留和分离高极性分析物的方法可包括离子色谱法、多孔石墨化/石墨碳柱和HILIC/混合模式色谱法。下面的色谱图显示了使用Waters的阴离子极性杀虫剂(APP)柱对各种阴离子极性杀虫剂的保留。
柱状固定相由乙烯桥接混合体(BEH)颗粒组成,带有三功能键的二乙胺(DEA)配体。 亲水表面和配体的阴离子交换特性的结合提供了非常适合保留和分离高极性阴离子化合物的色谱特性。
在这些条件下4,使用2.1 mm x 100 mm的APP柱,流速为0.5 mL/min,t0为0.46分钟,因此第一个洗脱的峰AMPA的RT为3.5 x t0,远在SANTE指南之内。
因此,如果你从头开始开发一个LC方法或实施从其他地方获得的现有方法,不要只关注保留时间的数值,而是要尽量确保在所使用的条件下,分析物的保留时间至少是与色谱柱空隙体积相应的保留时间的两倍。
- Appendix: HPLC Nomenclature, Waters Corporation: https://legacy-stage.waters.com/waters/en_US/Appendix%3A-HPLC-Nomenclature/nav.htm?cid=10049080&locale=en_US
- 文件编号:SANTE/12682/2019。食品和饲料中农药残留分析的分析质量控制和方法验证程序。
- 2002/657/EC:委员会2002年8月12日的决定,执行理事会关于分析方法的性能和结果解释的96/23/EC指令和污染物 22(3)。245–250.http://dx.doi.org/10.1080/02652030500110618
- 高水位食品中阴离子极性杀虫剂的测定,《水技术简报》720006645(2020)。