在整个开发和制造过程中的诱变性杂质风险评估
自从21世纪初,欧洲药品管理局(EMA)制定了第一份与诱变性杂质有关的指南后,就有必要评估诱变性杂质所带来的风险。 尽管最初人们认为避免是一种选择,但很快就发现这并不是一种可行的策略。 化学方法学的现状是,如果不使用有潜在致突变性或致突变性的试剂,就不可能构建合成分子;这些试剂是需要形成碳键的。 在确定了这一点之后,就成了一个风险评估和建立有效控制的问题。
ICH M7在ICH指南中是独一无二的,因为它适用于整个开发过程,而其他指南则可能只在申请上市时适用。 因此,在对有关药物进行任何临床评估之前,都需要进行诱变性杂质风险评估。 那么,如何进行评估呢? ICH M7对所需的内容进行了很好的概述。然而,重要的是要建立一个系统的方法来精确地进行实践中的风险评估。
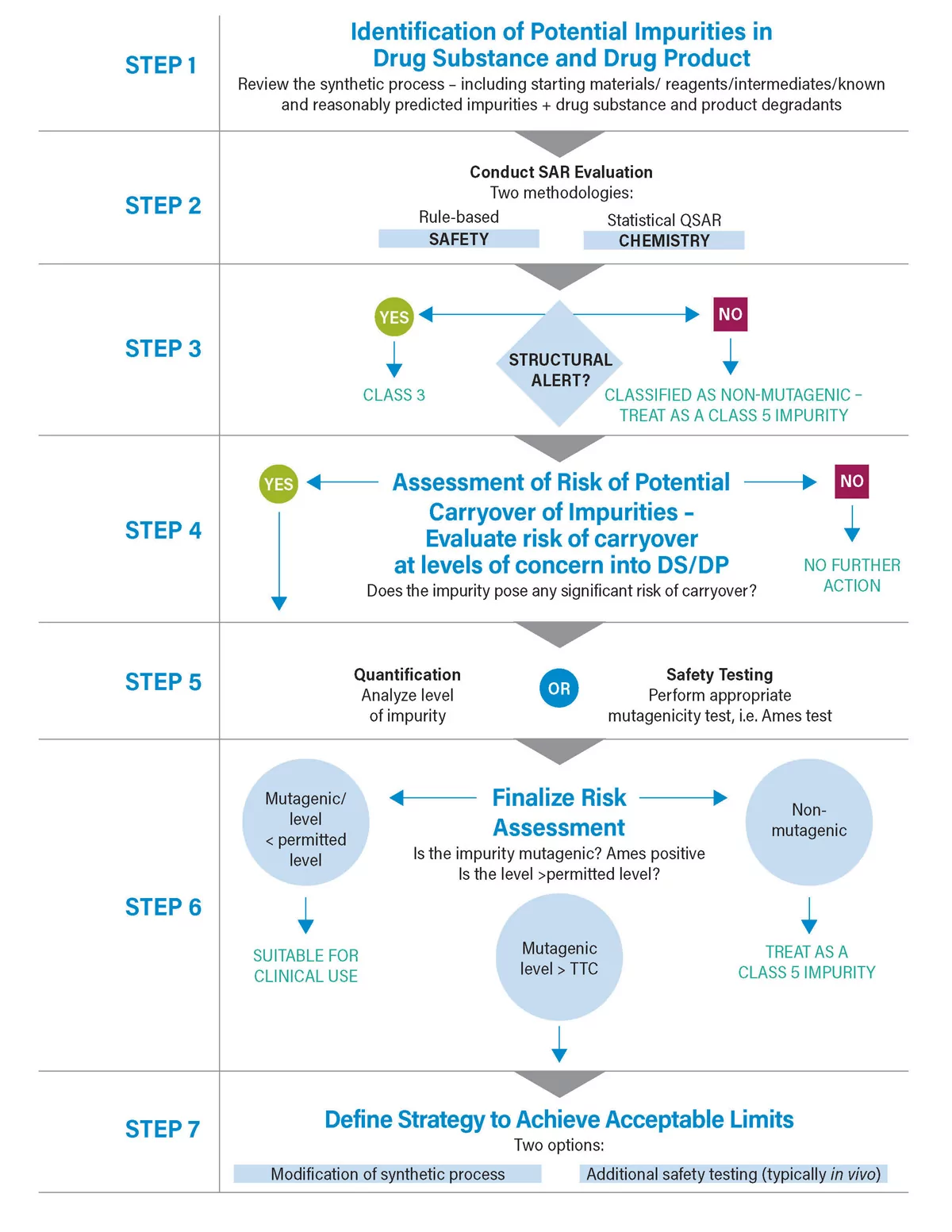
下面是一个描述一种潜在方法的流程图。 重要的是要注意这需要一个多学科的方法。在许多方面,这个过程可以被认为是一个接力;一旦一个方面完成,它就被移交给另一个学科,即从化学到安全,或从化学到分析,直到风险评估完成。 在最简单的术语中,风险评估需要回答两个问题。
- 是否存在与药品(包括活性物质和配方产品)的生产和储存有关的诱变性杂质?如果是,那么。
- 它们是否存在于令人担忧的水平上?
只有当问题2的答案是 "是 "时,才有问题。

简要检查一下每个步骤。 也许最困难的是步骤1:在工艺的什么地方和什么杂质应该被评估? ICH M7规定,这应该包括起始材料、试剂、中间产物、已确定的和合理预测的杂质。 其中,最具挑战性的是最后一项。 如何定义一个杂质是否是合理预测的所有可能的杂质? 最近与N亚硝胺有关的问题使这个问题成为焦点。 这是一个在生产过程中出现的意外的、非预测的、潜在的致癌杂质的案例,最后出现在多种药物产品中。现在需要的是对可能产生致突变杂质的潜在副反应的良好理解。 目前正在尝试确保在这一重要领域有更好的理解。
一旦确定了相关的杂质,下一步就是评估相关杂质的潜在诱变性,即SAR(结构活性关系)评估。 ICH M7的规定性很强,坚持使用仿真工具来完成这一工作,并规定使用两种不同的方法。它还强调了专家知识对评估结果的重要性。这种方法是可能的,因为结构和致突变性之间有很强的关联性。
SAR评估有效地过滤掉了接近90%的杂质,只留下少量的诱变性或潜在的诱变性化合物。 下一个阶段是进一步评估风险。 我们通过评估杂质的实际致突变性--通常是通过反向突变细菌试验--或通过计算或分析来评估在关注水平上的潜在携带性来做到这一点。
如果需要,ICH M7包括一些控制选项。选项4允许通过评估杂质的物理化学特性并将其与工艺条件(净化因子)相关联,来评估携带的可能性,从而证明控制。 如果这不能提供足够的保证,可能需要进行测试。考虑到所涉及的低含量和杂质的高反应性,这种痕量分析可能具有挑战性。
一旦收集了所有的数据,就可以完成风险评估,并回答关键的第二个问题(诱变性杂质是否存在于关注的水平上?) 经验表明,使用上述的系统性方法,通常可以证明对该杂质的控制。我的下一篇博客将深入探讨全球监管机构为量化和评估N-亚硝胺的存在而制定的程序。敬请关注!
Andy Teasdale博士是阿斯利康负责杂质管理和对外宣传的高级首席科学家。


