柱子也很重要。为NanoFlow和Microflow LC-MS选择最佳固定相

第2部分:考虑固定相的捕集和洗脱配置
在本系列的第一部分,我简要介绍了在蛋白质组学工作流程中实施捕集的一些基本机制、优势和注意事项。在设置蛋白质组学分离时,纳米或微流LC-MS的体积挑战和它的捕集器-洗脱器配置起到了至关重要的作用。
体积和洗脱方向都会引起带状增宽,从而使色谱效果恶化。这就是为什么我想在这里讨论反相蛋白质组分离的固定相的保留率和特性的影响,以及你如何利用它们来发挥你的优势。
- 第一部分:如何通过考虑分离本身来改善纳米和微流LC-MS蛋白质组学的研究
- 第二部分:为NanoFlow和Microflow LC-MS选择最佳固定相
- 第三部分:优化诱捕条件
聚焦样本的优势
了解用于多肽分离的捕集和稀释设置中的固定相的退避性,将使您在优化方法时获得显著优势。阻留性的不同是调用色谱分离的基础。
肽的滞留性受到许多因素的影响。
- 流动相
- 固定相的每一个方面(基粒特性、配体等)。
- 分析物的特性以及它与固定相的相互作用方式
在反相色谱中,亲水的多肽在任何C18固定相上都不会有很好的保留,而疏水的多肽会被强烈保留,并在分离的后期洗脱。因此,疏水的保留率是分离不同肽的决定性因素。
为了进一步优化分离,确保输送到质谱的纳流液相色谱分离的最佳峰容量,应尽量减少峰的分散。峰宽的这种不利影响可以通过 "再聚焦效应 "来缓解,即注入的分析物在柱子的入口处被强烈保留并形成一个窄带。
为了使注入的样品量集中,固定相需要能够在梯度开始时保留感兴趣的分析物。当进行捕集-稀释分离时,分析柱的固定相需要比捕集柱的固定相更具保留力,以便重新聚焦。关于相关理论的背景知识,我建议阅读Waters的HPLC入门手册。
竞争者
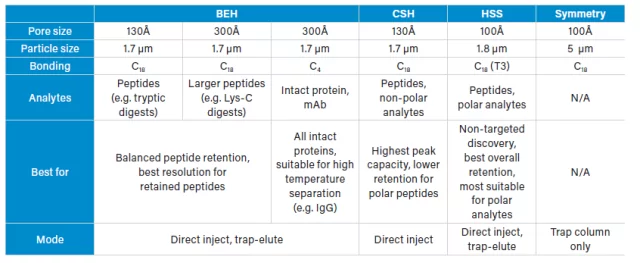
在直接进入多肽分离和复性的细节之前,我想简单介绍一下我们在多肽生物分析和一般的多肽和蛋白质定量中通常用于多肽分离的固定相。
桥式乙烯混合液(BEH)和带电表面混合液(CSH)是基于相同基础颗粒的固定相。CSH颗粒具有正的表面电荷,与BEH颗粒相比,它在多肽分离中具有不同的特性。高强度二氧化硅(HSS)提供了基于二氧化硅颗粒的滞留性和选择性,可用于传统二氧化硅颗粒会出现机械故障的较高压力下。最后,还有一种同样以二氧化硅为基础的对称性捕集柱。
这一切与你的肽分离有什么关系?让我们继续。
肽的滞后性
我们研究了nanoEase M/Z柱和iKeys中使用的常见固定相的多肽保留率。我们通过在梯度条件下注入多肽混合物并监测12个单独多肽的色谱。我们比较了洗脱12种肽的每一种所需的乙腈百分比,并向我们展示了每种固定相的保留率的差异。

在观察各个固定相时,我们可以分辨出各个肽的疏水性。乍一看,你也可以区分各个固定相的保留率。这已经是一组很好的数据了。
当我们进一步简化这个图表,并对洗脱12种肽所需的有机物(乙腈,ACN)的百分比进行平均,我们就能描绘出一幅非常简单而又容易理解的画面。
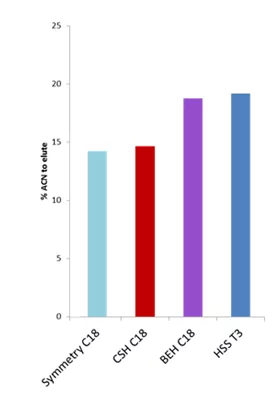
这张图告诉我们,Symmetry C18,捕集柱中使用的材料显示--平均来说--所有相中最低的肽保留率。BEH C18和HSS T3需要比Symmetry多5%左右的乙腈来洗脱肽。这是个好消息。
假设我们用15%的乙腈从Symmetry C18捕集器中洗脱一个分析物。同样的分析物在同样的流动相(15%乙腈)中仍将保留在下游的BEH C18或HSS T3分析型纳米LC柱上,以受益于再聚焦效应。而这将使一些伟大的色谱和分离良好的峰--这将导致更多的蛋白质和肽的鉴定。
但是,仔细观察,这也表明CSH这种对多肽具有出色的负载性和峰形的固定相可能不是捕集和稀释蛋白质组学的最佳人选。这就是为什么我一般建议使用CSH进行直接进样的多肽分离。
当然,这对你的样品的每一种化合物来说都不是绝对正确的,但在为蛋白质组学项目选择合适的固定相时,这是一个很好的起点。
更详细的情况
从本质上讲,我们发现能够配对不同的固定相以最适合你的分离需要是一个显著的优势,并能对你的结果产生非常积极的影响。
关于这背后的细节以及它对你的蛋白质组学纳米流LC-MS分析意味着什么,还有很多要讲。我的同事Moon Chul Jung在一篇关于为蛋白质组学的纳米和微流LC-MS选择正确固定相的优秀白皮书中总结了他的所有发现和比较。
另外,如果你错过了,我写了一篇关于一般捕集机制的短文,如正向和反向捕集洗脱。
额外资源
- 什么是微流水?
- 色谱柱也很重要:如何通过考虑分离本身来改进纳米和微流LC-MS蛋白质组学研究
- 由于减少了矩阵效应,Microflow LC提供了更好的灵敏度
- 沃特世公司的纳米和微型LC柱
- 白皮书:为蛋白质组捕集和洗脱纳米色谱法选择最佳固定相的考虑因素
- 想要更深入的了解吗?请回放我们最近由SelectScience主办的网络研讨会,选择最佳固定相的考虑,用于蛋白质组捕集和洗脱的纳米LC-MS,由Waters的Moon Chul Jung博士主讲。