Comprendre la complexité des échantillons : Détermination des effets de matrice dans les échantillons alimentaires complexes

Si le croisement des technologies de chromatographie et de spectrométrie de masse a révolutionné les laboratoires d'analyse des contaminants alimentaires, l'un de ses principaux inconvénients est le phénomène potentiel des effets de matrice. En raison d'interactions indésirables entre les analytes et la matrice de l'échantillon, la réponse de l'analyte peut être réduite ou amplifiée. L'influence de la matrice sur la fiabilité de votre méthode doit être déterminée lors de la mise en œuvre de nouvelles méthodologies, de nouveaux produits ou de nouveaux analytes dans le champ d'analyse de votre laboratoire.
Dans l'analyse GC-MS, la présence de sites actifs sur les revêtements et les colonnes d'analyse peut favoriser l'adsorption de certains groupes fonctionnels. L'excès de matrice, qui est généralement présent dans les extraits alimentaires, désactive ces sites et la réponse de l'analyte peut donc augmenter par rapport à la même concentration dans des extraits alimentaires ou à base de solvant plus propres. Ce phénomène est donc appelé "renforcement du signal induit par la matrice". Dans l'analyse LC-MS, l'ionisation par électronébulisation (ESI) reste la source d'ionisation la plus utilisée dans les laboratoires de routine, en raison de ses capacités de couverture étendue des composés. Cependant, l'ESI est également réputée pour son impact significatif sur l'efficacité de l'ionisation en présence de la matrice, ce qui a un impact sur la fiabilité de la détection.
Alors, qu'est-ce que la matrice ? Le livre d'or de l'UICPA indique simplement que la matrice est "les composants de l'échantillon autres que l'analyte". [1] Si l'on considère la variété des échantillons reçus dans les laboratoires d'essais de routine pour l'analyse des contaminants et des résidus, des tomates acides aux huiles comestibles grasses, la portée des composants de la matrice est vaste. Comprendre les types de produits représentatifs que votre laboratoire peut analyser au cours de la durée de vie de la méthode permet de guider les étapes de développement et d'optimisation de la méthode. Afin de surmonter l'impact de la matrice sur la détection de nos analytes d'intérêt, nous devons d'abord déterminer leur présence.
Détermination des effets de matrice
Bien que plusieurs options soient proposées pour mesurer l'impact de la matrice sur votre analyse, la théorie et la pratique de base sont les mêmes. Ces protocoles incluent la méthode d'infusion post-colonne et l'addition post-extraction. [2,3] Dans ce blog, nous nous concentrerons sur les protocoles relatifs à cette dernière, où une concentration connue d'analyte dans le solvant est comparée à la même concentration ajoutée à l'échantillon ou aux échantillons après extraction. Cette comparaison peut être effectuée sur des répliques(n=5 au moins) à une concentration fixe (équation 1) ou sur une série d'étalonnage (équation 2) couvrant une gamme de concentration plus large, où tous les échantillons doivent être préparés avec une composition de solvant similaire et acquis dans les mêmes conditions, au cours d'un seul cycle analytique.
Les données ainsi obtenues permettent de comparer la surface du pic des analytes, par exemple :
Équation 1 : Calcul du facteur d'effet de matrice
Où A : réponse du pic de l'analyte dans l'étalon de solvant et B : réponse du pic de l'analyte dans l'étalon apparié à la matrice( c'est-à-dire ajouté à l'échantillon alimentaire après extraction).
Si le résultat est inférieur à zéro (valeur négative), la réponse de l'analyte est supprimée par la matrice. S'il est supérieur à zéro (valeur positive), la réponse de la substance à analyser est renforcée par la matrice. En règle générale, les lignes directrices des meilleures pratiques recommandent de prendre des mesures pour compenser si les effets sont > 20 %, ce qui minimise l'erreur de déclaration des concentrations exactes de résidus encourus. [4-6]
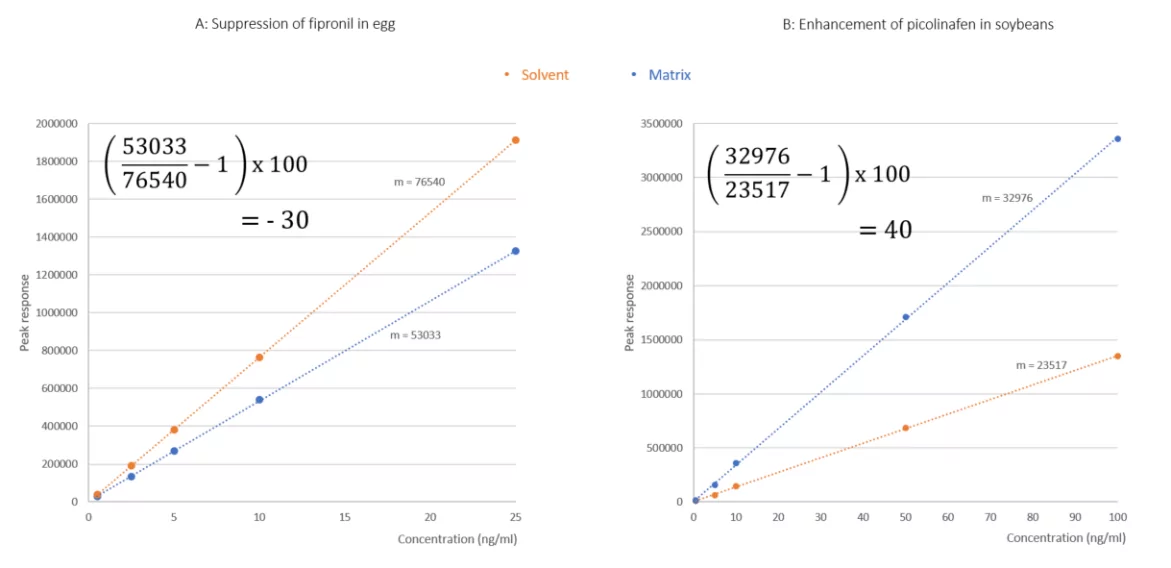
Une représentation graphique de ce calcul est présentée ci-dessous, où figurent les pics chromatographiques des analytes dans le solvant et les matrices. Dans la figure 1A, le fipronil dans le solvant (75:25 eau : acétonitrile) et la matrice (œuf cru, extrait avec QuEChERS et dilué, 75:25 eau : acétonitrile) sont superposés. L'axe des y (réponse du pic) pour les deux injections est lié, montrant ainsi la suppression du fipronil par la matrice co-extraite de l'échantillon d'œuf. De même, dans la figure 1B, le picolinafen dopé dans le solvant et le soja sont superposés, les axes des y étant liés. Dans cet exemple, la réponse du picolinafen dans le soja est significativement plus importante que dans le solvant. En utilisant l'équation 1, une suppression de 30 % a été déterminée pour le fipronil dans l'œuf et une augmentation de 40 % a été déterminée pour le picolinafen dans le soja. Dans ces deux exemples, des modifications de la méthode seraient nécessaires, afin de compenser ces effets de matrice et de garantir une quantification fiable des résidus encourus.

Comme pour la méthode précédente, les séries d'échantillons dans le solvant et la matrice sont générées à la même composition de solvant et acquises dans les mêmes conditions. La principale différence de cette méthode est la création de séries d'étalonnage, plutôt que de répétitions à une seule concentration. Les séries d'étalonnage doivent être préparées dans le solvant et la matrice, tous deux à des concentrations correspondantes, sur une plage de travail linéaire appropriée. Des courbes d'étalonnage individuelles sont tracées pour le solvant et la matrice, indiquant la réponse du pic de l'analyte en fonction de la concentration connue. À partir de chaque courbe, l'équation de la ligne est déterminée et la pente de chacune est comparée, comme suit :
Équation 2 : Calcul des effets de matrice à partir de la pente de la courbe
OùmA: pente de la ligne pour la série d'étalonnage basée sur le solvant et mB : pente de la ligne pour la série d'étalonnage basée sur la matrice.
En prenant les exemples du fipronil dans l'œuf et du picolinafen dans le soja déjà évoqués, leurs séries d'étalonnage, par rapport aux normes de solvant, sont superposées pour une comparaison visuelle. En insérant la pente calculée de chaque courbe dans chaque équation, on a de nouveau déterminé des effets de matrice de -30% et 40% pour le fipronil et le picolinafen, respectivement.
Les méthodes de détermination des effets de matrice présentées ici utilisent des échantillons de matrice enrichis après extraction, afin de limiter toute variation dans l'extraction initiale des analytes de la matrice. Si nous n'extrayons pas efficacement l'analyte au départ, nous pouvons attribuer une mauvaise détection aux effets de matrice, plutôt qu'à l'absence de l'analyte aux concentrations appropriées. Bien entendu, avant de déterminer les effets de matrice, il est important de prendre en compte l'extractibilité de l'analyte au cours des premières étapes d'extraction de la préparation de l'échantillon, si elle n'a pas déjà été déterminée par des méthodes de référence ou des recherches antérieures. Bien qu'un tel exercice puisse être réalisé en utilisant des étalons à base de solvant, l'utilisation de types de produits représentatifs offre une meilleure visibilité des performances réelles de la méthode et des interactions potentielles avec la matrice. L'efficacité avec laquelle un solvant peut extraire les analytes de la matrice est facilement déterminée de manière similaire aux effets de matrice :
Équation 3 : Calcul de la récupération de l'analyte par extraction
Où A : réponse du pic de l'analyte dans l'étalon de solvant et C : réponse du pic de l'analyte dans l'étalon extrait de la matrice(c'est-à-dire ajouté à l'échantillon alimentaire avant extraction).
Conclusion
Lorsque vous élargissez votre champ d'analyse, qu'il s'agisse de la méthodologie, des analytes ou des types de produits, il est important de comprendre l'extractibilité des analytes de la matrice et l'effet de la matrice co-extraite sur la détection des analytes. Ces facteurs peuvent être facilement déterminés à partir de l'acquisition de plusieurs échantillons de solvant et d'aliments dopés, où la composition du solvant et les paramètres d'acquisition doivent être constants, afin de s'assurer que toute variabilité est due uniquement à la matrice. Une fois que l'effet de la matrice sur la détection de l'analyte a été déterminé, les valeurs signifiant une suppression ou une amélioration de plus de 20 % nécessitent généralement une action pour compenser ces effets. Nous aborderons les meilleures actions pour votre laboratoire dans notre prochain blog sur les solutions pour surmonter la complexité de la matrice.
Références/ sources d'information :
[1] IUPAC Gold Book, Compendium de terminologie chimique de l'Union internationale de chimie pure et appliquée, 2019.
[2] M. Twohig, J. Mather, A. Hooper, A Tool for Robust Analytical Methods Development, Waters' Application Note, 2010.
[3] B.K. Matuszewski, M.L. Constanzer, C.M. Chavez-Eng, Strategies for the Assessment of Matrix Effect in Quantitative Bioanalytical Methods Based on HPLC-MS/MS, Anal Chem. 75, 13, 2003.
[4] Réseau EURL Pesticides, Procédures de contrôle de la qualité analytique et de validation des méthodes pour l'analyse des résidus de pesticides dans les denrées alimentaires et les aliments pour animaux, SANTE/12682/2019, 2019.
[5] US FDA, Guidelines for the Validation of Chemical Methods in Food, Feed, Cosmetics, and Veterinary Products, 3e édition, 2019.
[6] LGC National Measurement System, Guide to achieving reliable quantitative LC-MS measurements, première édition, 2013.
[7] Eurachem, The Fitness for Purpose of Analytical Methods A Laboratory Guide to Method Validation and Related Topics, deuxième édition, 2014.
Sujets populaires
ACQUITY QDa (16) bioanalyse (11) produits biologiques (14) biopharma (26) biopharmaceutique (36) biosimilaires (11) biothérapeutique (16) étude de cas (16) chromatographie (14) intégrité des données (21) analyse alimentaire (12) HPLC (15) LC-MS (21) chromatographie liquide (LC) (19) détection de masse (15) spectrométrie de masse (MS) (54) développement de méthodes (13) STEM (12)



