Les outils du succès chromatographique : Trois façons de favoriser la qualité des données dans les analyses de routine


Éviter les écueils de la qualité et de l'intégrité des données dans le laboratoire CQ de l'industrie pharmaceutique tout en effectuant des analyses de routine est un défi permanent. Les violations de la réglementation sont souvent le résultat d'un manque de données complètes, de données suspectes et de pistes d'audit inappropriées. Un rapport récent de Deloitte Il est indiqué que les violations de l'intégrité des données représentent plus de 70 % des lettres d'avertissement émises dans le monde.
L'intégration correcte des pics chromatographiques dans le but de garantir la qualité et l'intégrité des données fait l'objet d'une attention particulière lors des audits réglementaires. L'une des approches permettant de répondre aux attentes des organismes de réglementation en matière d'audit des pratiques d'intégration des pics consiste à moderniser et à améliorer les performances de vos analyses chromatographiques. Mais les coûts des licences réglementaires et de la validation des méthodes augmentent alors que les budgets des laboratoires diminuent, ce qui peut vous décourager d'apporter des changements substantiels à vos méthodes.
Regardez le webinaire de Heather Longden et du Dr Paula Hong à la demande ici.>>
Quelles améliorations simples de la méthode pouvez-vous apporter pour renforcer la confiance des examinateurs dans la conformité de vos données, tout en vous facilitant la vie ?
Voici trois façons de relever les défis chromatographiques les plus courants dans vos analyses pharmaceutiques de routine et de favoriser votre réussite.
1. Obtenez une intégration précise des pics dès la première fois
Les organismes de réglementation estiment souvent que les méthodes d'essai ne permettent pas de démontrer la pureté des médicaments. Pourquoi ? En partie parce que les analystes ont du mal à obtenir une intégration précise des pics dès la première fois. Dans une observation réglementaire spécifique rapportée par la FDA, il a été constaté que les données avaient été retraitées jusqu'à 12 fois, avec seulement le résultat final inclus dans le rapport pour examen par l'assurance qualité.
Ce type d'événement suscite des inquiétudes quant à l'exhaustivité des données sécurisées ou soumises. Il est extrêmement courant et scientifiquement sain d'optimiser les paramètres d'intégration des pics ; cependant, l'observation réglementaire citée a été interprétée comme une manipulation importante des données, surtout lorsque la réponse du responsable était qu'il était typique de jouer avec les paramètres d'intégration. Il y avait une incohérence marquée concernant l'intégration des impuretés de faible niveau dans les chromatogrammes entre les utilisateurs. De plus, l'absence d'un protocole approuvé pour l'intégration manuelle a entraîné des différences dans les résultats des pics. Ces types de méthodes d'essai peuvent conduire à une intégration incohérente des pics de coélution. L'intégration incohérente des pics et des méthodes d'analyse inadéquates peuvent conduire à une incapacité à détecter les impuretés, ce qui entraîne la mise sur le marché de médicaments frelatés.
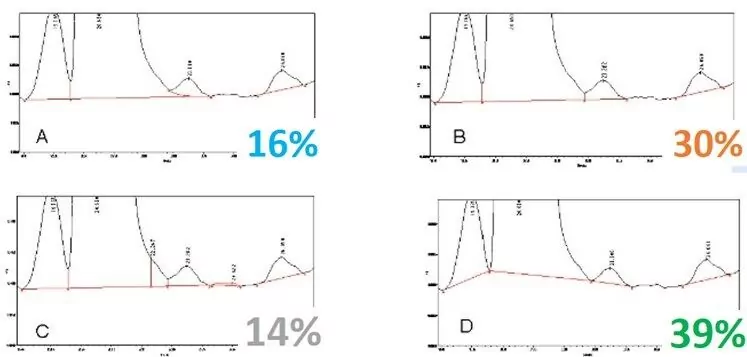
Quelle est la bonne intégration du pic ? Voici les réponses à un récent sondage :
La plupart des personnes interrogées ont choisi D, ce qui est courant et facile à faire, mais si les hauteurs de pic changent, la hauteur de la vallée change, et les surfaces changent considérablement. D sous-estime la quantité d'impureté, tandis que C la surestime. A et B sont probablement les mesures les plus précises des aires de pic, A intégrant plus précisément l'impureté.
2. Comprendre comment des changements peuvent être apportés à vos méthodes d'analyse sans nécessiter une pré-approbation réglementaire.
Si vous pouvez améliorer la méthode pour qu'elle ne soit pas trop contraignante, vous pouvez réduire la manipulation manuelle. En fin de compte, cela réduit les inquiétudes que les régulateurs pourraient avoir sur l'intégrité des données, en soupçonnant par exemple que les données ont été manipulées pour être conformes.
L'une des causes courantes des problèmes d'intégrité des données est que les méthodes d'analyse choisies sont souvent anciennes et n'ont pas été modernisées depuis leur développement initial. Cela peut les rendre inadéquates pour une utilisation dans un laboratoire d'analyse moderne.
Les efforts déployés par les organismes de réglementation mondiaux et la Conférence internationale sur l'harmonisation (ICH) laissent entrevoir des perspectives positives pour faciliter les modifications post-approbation visant à améliorer les méthodes d'analyse. L'approche Product Lifecycle - ICH Q12 comprend spécifiquement des exemples sur la façon dont des changements peuvent être apportés aux méthodes d'analyse sans nécessiter d'approbation préalable des autorités réglementaires. En outre, les organismes de réglementation mondiaux et l'ICH travaillent à l'élaboration d'un nouveau guide sur le développement des méthodes d'analyse - ICH Q14, qui vise à intégrer davantage de connaissances dans la soumission d'une méthode d'analyse. De plus, une équipe de travail de l'ICH est en train de revoir la validation des méthodes - ICH Q2 (R2) pour couvrir la validation améliorée et la validation des techniques analytiques modernes.
Il est essentiel de disposer de méthodes robustes qui fonctionnent de manière fiable sur des systèmes performants afin d'atténuer l'échec de l'adéquation du système.
Voici ce que les personnes interrogées lors d'un récent sondage avaient à dire sur les échecs des tests de conformité des systèmes et les transferts de méthodes :
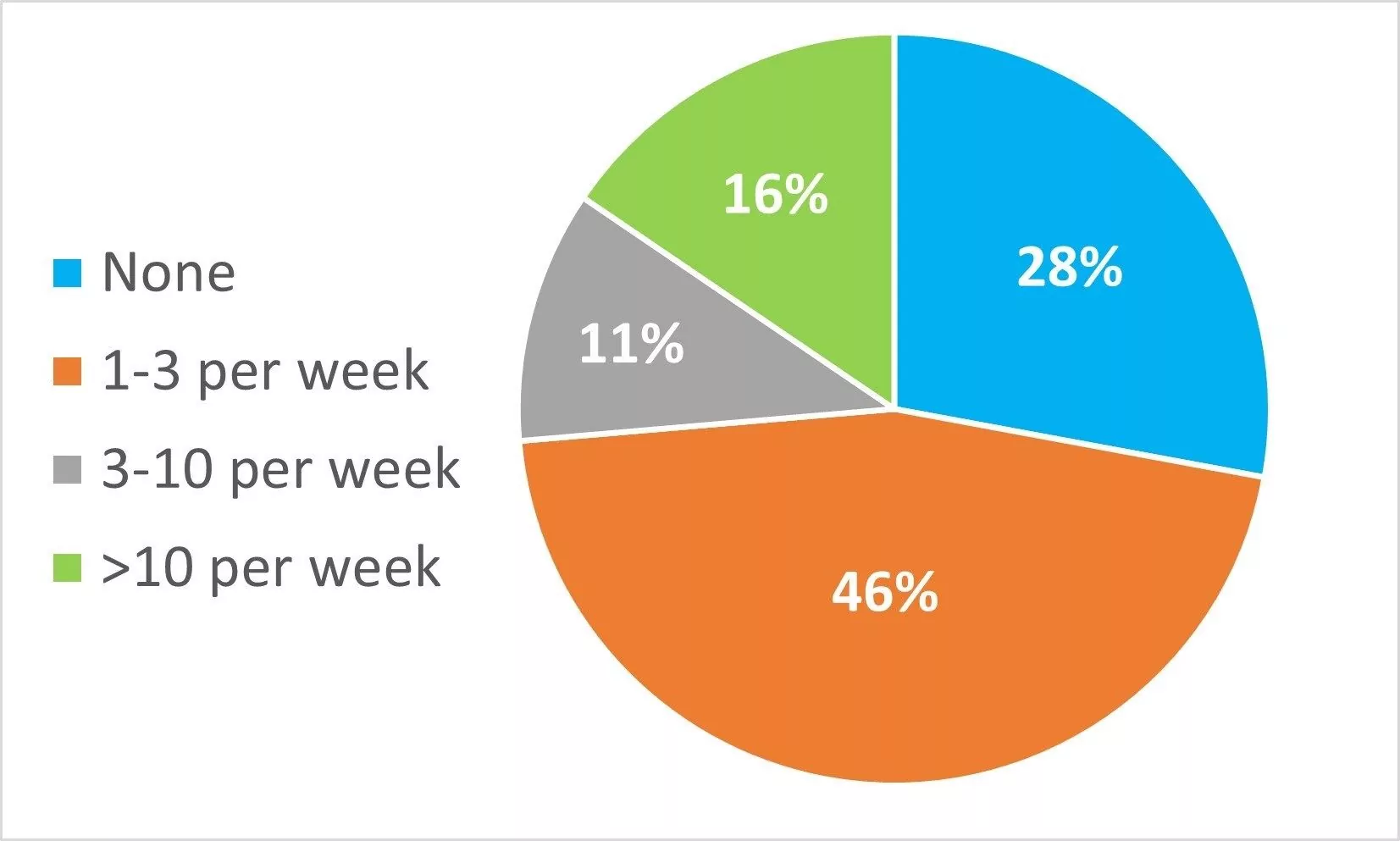
Dans votre laboratoire, combien d'ensembles d'échantillons par semaine doivent être invalidés et répétés parce que le système de test adéquat échoue ?
Seuls 28 % des répondants ont déclaré avoir rarement à invalider et à ré-exécuter des résultats et 16 % ont déclaré avoir à invalider et à ré-exécuter plus de 10 ensembles d'échantillons par semaine, ce qui entraîne une perte de temps et des coûts importants.
Lorsque vous transférez des méthodes dans le CQ, est-ce que vous avez l'habitude de :
Pour améliorer le succès du transfert de méthodes, la plupart des répondants ont indiqué qu'ils utilisaient les temps de rétention relatifs comme critères. Cependant, il existe également un nombre important de laboratoires qui profitent des problèmes de transfert de méthodes pour moderniser leurs méthodes.
3. Assurez-vous que votre système HPLC est à la hauteur de la tâche.
Avec sa capacité à améliorer les performances, le système HPLC Arc est conçu pour relever les principaux défis chromatographiques. Grâce à la possibilité d'exécuter des méthodes HPLC existantes et des méthodes améliorées sur des colonnes HPLC à particules plus petites, telles que 3,5 µm, le système fournit des injections précises et hautement reproductibles, ce qui vous permet d'être sûr de respecter vos spécifications en matière d'écart-type relatif (RSD) sans avoir à ré-exécuter vos échantillons. Il n'est donc plus nécessaire d'optimiser en permanence les paramètres d'intégration des pics et le temps passé à étudier des résultats anormaux est réduit.
Le nouveau système HPLC Arc de Waters vous offre une mise à niveau transparente des systèmes quaternaires et binaires existants, avec une qualité de séparation et des temps de rétention comparables. La mise à niveau vers un système moderne comme l'Arc HPLC vous permet d'améliorer les méthodes existantes en offrant plus de flexibilité et en augmentant l'efficacité, avec une précision d'injection et des limites de contre-pression plus élevées.
Les améliorations des performances et de la robustesse des instruments HPLC peuvent également contribuer à l'amélioration globale de la qualité et de l'intégrité des données. Les critères d'adéquation du système pour les méthodes de routine sont facilement atteints, y compris pour les monographies USP. En outre, l'Arc HPLC offre une tolérance accrue à la contre-pression, ce qui vous permet d'utiliser des débits élevés avec des colonnes à particules plus petites, réduisant ainsi le temps d'exécution, les coûts, la consommation de phase mobile et, surtout, la résolution et la sensibilité des pics. Les instruments modernes, tels que le système Arc HPLC, sont conçus pour assurer la reproductibilité des gradients peu profonds de la HPLC, tels qu'ils sont généralement utilisés dans de nombreuses méthodes réglementées (USP).
Il est temps d'apporter des améliorations, car les nouvelles possibilités réglementaires de gestion des changements post-approbation sont imminentes. Les lignes directrices actualisées influenceront la manière dont les méthodes chromatographiques sont élaborées et documentées, ce qui entraînera un examen et une surveillance accrus des exigences en matière d'adéquation du système et de reproductibilité afin de réduire les erreurs de mesure et de garantir davantage la qualité globale des données.
En trouvant des moyens d'améliorer facilement vos méthodes et de garantir une analyse "correcte dès la première fois", vous aurez une plus grande confiance dans vos données et dans la confiance des organismes de réglementation dans les résultats que vous présentez ou soumettez. Le fait de s'appuyer sur Waters en tant que partenaire de confiance permet de garantir le succès dans tous les domaines de l'analyse de routine.
Heather Longden, directrice principale du marketing, Pharmaceutical Intelligence, Waters Corporation
Paula Hong, PhD, scientifique consultante principale, Waters Corporation
Vous voulez en savoir plus ?
Regardez le webinaire à la demande d'Heather et Paula : Assurer la qualité des données et relever les défis chromatographiques dans l'analyse pharmaceutique de routine : Les outils de la réussite
En outre, vous trouverez ci-dessous d'autres ressources spécialisées pour votre analyse HPLC :
- Discussion de groupe : Les nouvelles directives et les solutions chromatographiques modernes convergent pour garantir la qualité des données dans les laboratoires pharmaceutiques : Le point de vue de l'USP et de la MHRA
- Article : Une étape simple pour améliorer votre analyse HPLC de routine
- App Brief : Transfert de méthode d'un gradient rapide d'un système HPLC binaire à un système Arc HPLC
- App Brief : Système Arc HPLC : Amélioration de la productivité et transfert sans faille d'une méthode HPLC pour les impuretés
Sujets populaires
ACQUITY QDa (16) bioanalyse (11) produits biologiques (14) biopharma (26) biopharmaceutique (36) biosimilaires (11) biothérapeutique (16) étude de cas (16) chromatographie (14) intégrité des données (21) analyse alimentaire (12) HPLC (15) LC-MS (21) chromatographie liquide (LC) (19) détection de masse (15) spectrométrie de masse (MS) (54) développement de méthodes (13) STEM (12)