Échantillons perdus dans le conteneur : La liaison non spécifique et l'impact des agents bloquants

Mon échantillon est resté dans la solution... ou pas ?

Qu'est-il arrivé à mon précieux échantillon ?
Une telle liaison inattendue à la surface est appelée liaison non-spécifique (NSB) ou adsorption non-spécifique (NSA). Ces termes proviennent à l'origine des essais de liaison de ligands, où l'on s'attend à ce qu'un analyte soit capturé uniquement par l'interaction spécifique entre l'analyte et ses récepteurs. Toutes les autres liaisons sont qualifiées de non spécifiques. De nos jours, les termes NSB et NSA sont utilisés pour décrire toutes les interactions de liaison qui n'ont pas été prévues et la perte d'analyte qui en résulte.
Le NSB peut ruiner une expérience bien planifiée. Il peut conduire à des résultats quantitatifs inexacts, ou pire encore, vous pouvez ne pas obtenir de signal du tout !
Comment éviter ce problème épineux et est-ce efficace ?
Ce problème des NSB n'est pas du tout nouveau. Il est largement connu des biologistes qui s'occupent depuis longtemps de protéines et de peptides. Pour éviter ce problème, les scientifiques ont imaginé de nombreuses solutions de contournement basées sur ces deux principes :
- Principe 1 - Modifier l'environnement chimique pour éliminer ou réduire les interactions indésirables.
- Modification du pH de la solution pour réduire les interactions ioniques
- Ajout de sels pour modifier la force ionique
- Ajout d'un solvant organique à la solution
Comme chaque analyte est chimiquement unique, il n'existe pas de condition unique pouvant être appliquée à tous les échantillons. En outre, la modification du pH ou l'ajout d'un solvant organique peut altérer les propriétés de la biomolécule, comme son état de charge ou sa structure pliée. L'ajout de sel à l'échantillon peut favoriser la suppression des ions dans la détection par SM.
- Principe 2 - Ajout d'un agent bloquant pour recouvrir les sites potentiels de NSB à la surface.
- Ajout de polymères comme le PEG
- Ajout de détergents comme le Tween-20 ou le Triton X-100
- Ajout de protéines porteuses comme l'albumine de sérum bovin (BSA) ou la caséine.
L'ajout d'un agent bloquant revient à réintroduire des impuretés dans les échantillons nettoyés. Les détergents et les grands polymères sont particulièrement nuisibles aux analyses LC-MS car ils peuvent altérer la sélectivité de la colonne et augmenter le bruit de fond. Ils sont connus pour avoir un impact sur l'ionisation du MS et induire une suppression importante des ions. De plus, il est extrêmement difficile de les éliminer de la colonne et des autres composants du système.
Bien qu'il soit très efficace, l'utilisation d'un agent bloquant n'est peut-être pas la meilleure option pour préparer les échantillons LC-MS.
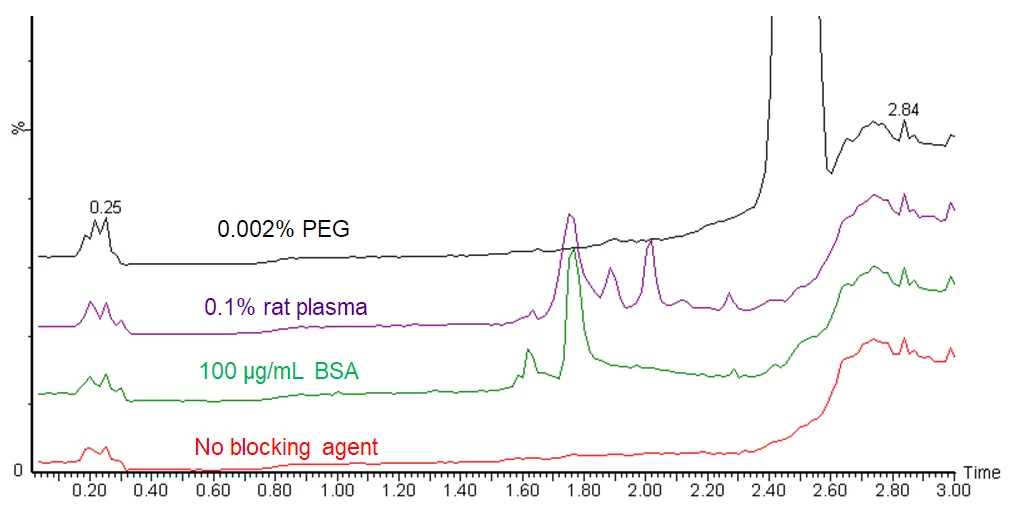
L'ajout d'une protéine porteuse est une alternative moins problématique que l'utilisation de détergents et de polymères. C'est une solution plus favorable pour les échantillons LC-MS, mais ce n'est néanmoins pas la solution parfaite. Les protéines peuvent apparaître comme des pics d'impureté dans les chromatogrammes, voir figure.
On peut éviter de voir les pics d'impuretés en utilisant une méthode de surveillance à masse unique ou une méthode SRM pour ne surveiller que les analytes cibles, mais ces impuretés peuvent toujours avoir un impact sur votre analyse en arrière-plan par la suppression ou l'augmentation des ions. Dans les analyses à balayage complet, elles apparaissent comme des pics supplémentaires dans les spectres MS, ce qui complique l'interprétation. En outre, il est plus difficile de manipuler des solutions qui contiennent une forte concentration de protéines. Ayant à la fois des régions hydrophiles et hydrophobes, les protéines en solution se comportent comme des surfactants. Les solutions de protéines forment facilement de la mousse, ou des bulles, et la formation de mousse pendant le pipetage peut entraîner des erreurs de mesure.
Dans certains cas, un agent bloquant est nécessaire, mais il est bien plus souhaitable de pouvoir réaliser des échantillons sans agent bloquant.
Jusqu'à présent, nous avons réfléchi aux problèmes de liaison non spécifique (NSB) et aux avantages et inconvénients des approches courantes pour éviter la NSB. Dans le prochain article, nous verrons comment ces limitations affectent votre flux de préparation d'échantillons.
Surveillez notre prochain article de blog "Préparation des échantillons avant la quantification LC-MS des peptides et des protéines" par Kim Haynes.
Ressources supplémentaires :
Boot Camp sur la bioanalyse des peptides et des protéines
Cartes de référence pour la bioanalyse des peptides Oasis
Informations sur le produit d'extraction d'échantillons Oasis
Sujets populaires
ACQUITY QDa (16) bioanalyse (11) produits biologiques (14) biopharma (26) biopharmaceutique (36) biosimilaires (11) biothérapeutique (16) étude de cas (16) chromatographie (14) intégrité des données (21) analyse alimentaire (12) HPLC (15) LC-MS (21) chromatographie liquide (LC) (19) détection de masse (15) spectrométrie de masse (MS) (54) développement de méthodes (13) STEM (12)