Les colonnes ont aussi leur importance : comment améliorer la protéomique LC-MS à nano- et micro-débit en tenant compte de la séparation elle-même

Partie 1 : Comment une configuration piège et lutrin peut résoudre de nombreux problèmes dans la LC-MS protéomique à nanoflux et microflux
Lors de discussions avec des scientifiques qui travaillent activement avec des systèmes LC-MS à l'échelle nanométrique et à microécoulement (par exemple, en protéomique et en cartographie peptidique), je trouve intéressant de constater qu'une grande quantité d'efforts est consacrée à la configuration du système, comme les connexions des fluides ou les paramètres de collecte des données MS.
Bien que ces éléments soient évidemment importants, ce qui me surprend, c'est que l'on consacre relativement peu de temps au choix des phases stationnaires pour les colonnes de piégeage et d'analyse. Il s'agit d'un peptide - vous allez donc utiliser des colonnes C18, n'est-ce pas ? Pas tout à fait.
Dans cette série en trois parties, nous allons explorer comment une association optimale de phases stationnaires peut améliorer considérablement vos résultats de LC-MS en nanoflux et microflux.
- Partie 1 : Comment améliorer la protéomique LC-MS en nano- et micro-flux en considérant la séparation elle-même
- Partie 2 : Choisir la meilleure phase stationnaire pour les LC-MS NanoFlow et Microflow
- Partie 3 : Optimiser les conditions de piégeage
Lors de l'examen des choix de nano et micro-colonnes, deux aspects sont souvent négligés :
- Le piégeage et les différents ensembles de configurations de piégeage, qui ont tous un but spécifique et aident le scientifique à atteindre son objectif d'optimisation des séparations et du débit d'échantillons.
- Le choix d'une phase stationnaire et de combinaisons de phases stationnaires pour les colonnes de piégeage et les colonnes analytiques et l'impact que cela peut avoir sur le résultat de l'analyse, depuis la résolution, la largeur du pic et la capacité du pic jusqu'au nombre de peptides identifiés ou d'autres espèces d'intérêt.
Examinons de plus près les bases du piégeage ainsi que les avantages et les considérations liés à la mise en œuvre d'une étape de piégeage dans une séparation LC.
Nous savons que la LC-MS à nano- et micro-débit tire profit de la miniaturisation de la chromatographie et de l'interface LC-MS d'au moins deux manières significatives. Les petits volumes d'échantillons et l'efficacité de l'ionisation et de l'échantillonnage MS, ainsi que la réduction des effets de matrice, ont tous deux un impact positif sur le rapport signal/bruit, ou la sensibilité, de l'analyse LC-MS.
Problèmes volumétriques dans les LC-MS à nano- et micro-débits
Toutefois, la sensibilité accrue des analyses par nanoLC peut facilement être compromise par de mauvaises méthodes expérimentales. Le volume réduit de la colonne rend la nano et micro LC plus vulnérable aux incompatibilités dans les conditions chromatographiques qui pourraient n'avoir aucun impact sur une colonne analytique à plus grande échelle.
Par exemple, une colonne de 75 µm de diamètre intérieur (D.I.) pour nanoLC a un volume de colonne 780 fois plus petit qu'une colonne analytique de 2,1 mm de D.I. de même longueur. Injecter, par exemple, un échantillon de 5 µl directement sur une colonne de 75 µm de diamètre interne reviendrait à injecter un échantillon de 3,9 ml sur une colonne de 2,1 mm de diamètre interne. Et cela se traduirait très probablement par un désordre chromatographique.
Avec ces quantités d'injection, les particules ou autres espèces problématiques telles que les protéines ou les lipides résiduels peuvent montrer leur caractère gênant en quelques injections. L'entrée de la colonne nanoLC peut se boucher ou le garnissage de la colonne peut s'encrasser et perdre sa rémanence. De plus, à ces volumes d'injection, la force du solvant de toute étape de préparation de l'échantillon en amont (en ligne ou hors ligne) pourrait également perturber la séparation chromatographique.
Et je ne mentionne même pas les temps de chargement incroyablement longs de l'échantillon sur la colonne d'analyse : À un débit typique de 300 nL/min, il faudrait environ 17 minutes pour simplement rincer un volume de 5 µL. Si la boucle d'échantillonnage est plus grande, le temps nécessaire sera encore plus long.
Colonnes pièges
C'est là qu'une configuration de type "trap-and-elute" résout de nombreux problèmes dans les LC-MS protéomiques à nano- et micro-flux. Dans cette configuration, l'échantillon est d'abord injecté et concentré sur la colonne de piégeage. Une colonne de piégeage est conçue pour permettre cette étape à des débits élevés dans un laps de temps relativement court en utilisant un matériel de plus grand diamètre interne et des particules plus grandes que la colonne analytique respective.
Le piège filtre les impuretés ou les espèces indésirables dans l'échantillon, tout en retenant les analytes d'intérêt. Dans l'étape suivante, les analytes piégés sont reconstitués dans la phase mobile et élués sur la colonne d'analyse au débit le plus faible pour la séparation analytique.
Avantages du piégeage :
- Augmentation de la vitesse de chargement de l'échantillon
- Augmentation de la charge volumétrique et donc de la charge massique sur la colonne, ce qui entraîne une augmentation de la plage dynamique de l'analyse nanoLC-MS.
- Nettoyage supplémentaire de l'échantillon avant l'injection sur la colonne analytique
Essentiellement, une colonne de piégeage est une zone d'attente et de nettoyage pour l'échantillon injecté avant que les composants ne soient élués et séparés avec une haute résolution sur la colonne analytique en aval.
Bien entendu, l'utilisation de la méthode "trap-and-elute" nécessite un peu de développement méthodologique. Si une méthode de piégeage bien optimisée permet d'obtenir tous les avantages décrits, une méthode de piégeage mal conçue peut entraîner non seulement une perte de l'intensité du signal MS, mais aussi une perte de l'analyte.
Configurations des systèmes de piégeage et d'élucidation
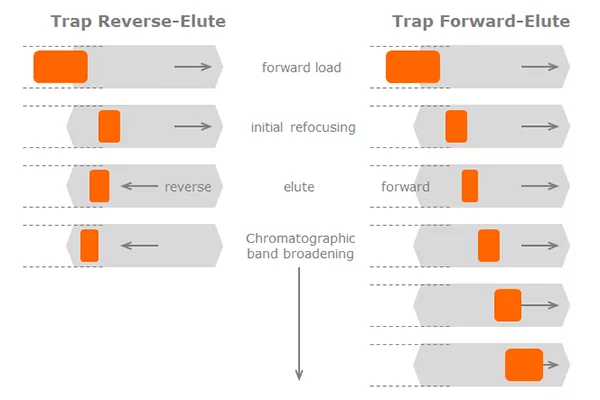
Les deux principales configurations de système pour l'élution par piégeage sont soit l'élution par piégeage avant, qui est la configuration la plus basique, soit l'élution par piégeage inverse, plus sophistiquée. Chacune de ces configurations présente des avantages et des inconvénients.
Dans la configuration forward-trap-elute, l'échantillon est simplement chargé depuis la vanne d'injection sur la colonne du piège, nettoyé, et poussé à travers la sortie de la colonne du piège sur la colonne analytique. La vanne du piège permet au flux d'écoulement de ne pas atteindre la colonne analytique pendant l'étape de chargement et de nettoyage du piège. Ce chemin d'écoulement sera fermé et le flux sera forcé sur la colonne analytique pendant l'étape d'élution.
Dans la configuration "reverse-trap-elute", l'échantillon est également chargé sur la colonne de piégeage dans le sens normal du flux. Cependant, une fois l'étape de chargement et de nettoyage terminée, le sens d'écoulement est inversé en commutant la vanne du piège. L'échantillon est élué en sens inverse, par l'entrée de la colonne de piégeage, sur la colonne d'analyse. Une pompe secondaire permet de s'assurer que la colonne analytique reçoit toujours un flux de phase mobile, même pendant l'étape de chargement.
Chargement de l'échantillon et élution
Avant de plonger dans le piégeage et l'élution de l'échantillon, je voulais juste rappeler au lecteur la courbe de van Deemter et sa signification pour la chromatographie - elle indique essentiellement que si une bande chromatographique migre le long d'un lit tassé à une vitesse linéaire non optimale, la bande chromatographique subit un élargissement important. Cet effet est plus prononcé pour les particules de grande taille, par exemple celles utilisées dans les colonnes de piégeage, que pour les particules de petite taille utilisées dans les colonnes analytiques à nano- et micro-flux. L'incliné peut vouloir lire ce superbe article sur l'élargissement de la bande en chromatographie.
Dans les deux cas de piégeage, l'étape de chargement se fait à des débits élevés et à travers l'entrée de la colonne de piégeage. Idéalement, la bande d'analyte injectée est retenue et donc quelque peu focalisée près de l'entrée de la colonne de piégeage. Le degré de concentration des analytes et le volume de colonne qu'ils occupent dépendent bien sûr de l'hydrophobie de l'analyte.
Lors de l'élution, le débit est réduit pour maximiser l'efficacité de la séparation analytique dans la nanocolonne - généralement à un débit très faible adapté aux petits alésages de la nanocolonne. Si l'analyte est élué dans le sens direct (la même direction que le flux de chargement), l'échantillon doit migrer sur toute la longueur du lit tassé du piège à une vitesse qui n'est pas optimale (n'oubliez pas que le matériel et les particules du piège sont beaucoup plus grands que ceux des nanocolonnes) - c'est la recette pour un élargissement significatif de la bande.
Lorsque le piège est élué dans le sens inverse de l'écoulement, la bande d'analyte ne doit migrer que sur une courte distance le long du lit tassé - l'effet d'élargissement de la bande sera nettement moins prononcé. Cette réduction de l'élargissement de la bande est un avantage important de la méthode de piégeage et d'élution inversée. Il existe un moyen d'inverser quelque peu l'effet d'élargissement de la bande. Cette méthode n'est pas toujours possible, mais elle peut être puissante si elle est utilisée correctement.
Cela dépend toujours de votre échantillon et de sa matrice...
Dans cet article, j'ai abordé les deux configurations les plus courantes des systèmes de piégeage et d'élution et j'ai souligné l'impact potentiel sur la qualité de la séparation chromatographique, selon que l'on utilise la méthode plus simple de piégeage et d'élution en avant ou la méthode plus complexe de piégeage et d'élution en arrière. La réponse correcte, bien sûr, n'est pas définitive et variera beaucoup en fonction de la nature de l'échantillon et de la matrice de l'échantillon. Cependant, je pense que les réflexions ci-dessus devraient être prises en compte lors de l'évaluation de votre séparation par nano- ou micro-flux. Car, en fin de compte, nous nous soucions probablement tous davantage du nombre de protéines et de peptides identifiés ou de la précision de la quantification lorsque nous choisissons une méthode plutôt qu'une autre.
Dans le prochain article, j'aborderai l'impact des phases stationnaires et la manière de choisir la phase stationnaire optimale pour la LC-MS en nano- et micro-flux avec piège et élution pour les analyses de peptides.
Ressources supplémentaires
Ma collègue Patty Sun a écrit deux merveilleux articles sur l'amélioration de l'efficacité de l'échantillonnage et les effets de matrice. Je vous recommande de les lire pour des réflexions plus approfondies sur ces sujets :
- Qu'est-ce que le microflow LC
- Microflow LC offre une meilleure sensibilité grâce à la réduction des effets de matrice
- Colonnes LC Nano et Micro de Waters
- Livre blanc : Considérations pour la sélection des phases stationnaires optimales pour la nanochromatographie protéomique de type "Trap-and-Elute".
- Vous voulez approfondir le sujet ? Regardez notre récent webinaire organisé par SelectScience, Considerations for Selecting the Optimal Stationary Phases for Proteomic Trap-and-Elute NanoLC-MS, avec Moon Chul Jung, Ph.D., de Waters.
Sujets populaires
ACQUITY QDa (16) bioanalyse (11) produits biologiques (14) biopharma (26) biopharmaceutique (36) biosimilaires (11) biothérapeutique (16) étude de cas (16) chromatographie (14) intégrité des données (21) analyse alimentaire (12) HPLC (15) LC-MS (21) chromatographie liquide (LC) (19) détection de masse (15) spectrométrie de masse (MS) (54) développement de méthodes (13) STEM (12)