Les colonnes ont aussi leur importance : Choisir les conditions optimales pour le trappage et l'élution des LC-MS à nanoflux et à microflux

Partie 3 : Optimiser les conditions de piégeage
Le précédent volet de cette série traitait des détails, des effets et des avantages des phases stationnaires pour l'analyse protéomique des peptides et de la façon dont la rémanence du piège et de la colonne analytique peut améliorer votre séparation des peptides. Ici, je voulais aborder brièvement les conditions de piégeage telles que le débit et le volume de piégeage car, d'après mon expérience, c'est un paramètre souvent négligé.
- Partie 1 : Comment améliorer la protéomique LC-MS en nano- et micro-flux en considérant la séparation elle-même
- Partie 2 : Choisir la meilleure phase stationnaire pour les LC-MS NanoFlow et Microflow
- Partie 3 : Optimiser les conditions de piégeage
Les bases du piégeage
Les colonnes de piégeage ont généralement un diamètre intérieur plus grand et sont remplies de particules plus grosses que leur homologue analytique. Cela permet de charger un plus grand volume d'échantillon à des débits plus élevés, comme nous l'avons vu dans un article précédent. Un piégeage efficace permet de capturer tous les analytes d'intérêt dans un échantillon plus grand tout en éliminant les composés interférents. Pour cela, il faut que les composés les plus hydrophiles soient encore retenus pendant l'étape de piégeage, et qu'il soit possible d'éluer tous les analytes dans de petits volumes pour réussir à refocaliser les bandes sur la colonne analytique.
D'une manière générale, l'utilisation du piégeage peut augmenter la gamme dynamique de vos analyses en permettant d'injecter plus d'échantillon et en réduisant les effets négatifs de la matrice de l'échantillon.
Considérations pour l'optimisation des conditions de piégeage
La perte de peptides hydrophiles pendant l'étape de piégeage n'est pas rare, car la récupération des peptides dépend en grande partie de la rétention. La récupération des peptides peut être optimisée en ajustant les conditions de piégeage en conséquence.
Comme la rétention de la colonne de piégeage est idéalement inférieure à celle de la colonne d'analyse et qu'elle est donc fixe, l'un des paramètres à ajuster est la force du solvant pendant le processus de piégeage. Des solvants moins forts permettront de mieux capturer les espèces moins rétentives sur la colonne de piégeage.
De plus, le volume de chargement doit être suffisamment grand pour transporter l'échantillon de la boucle d'injection au piège et pour laver les composés indésirables, tels que les sels et autres interférences ioniques. Mais le volume de piégeage doit être suffisamment petit pour éviter le lavage des peptides faiblement retenus. Il faut également tenir compte de la composition du solvant de l'échantillon injecté et de la façon dont elle peut affecter la composition du solvant final pendant le processus de chargement. De plus, le débit pendant le processus de piégeage doit être optimisé.
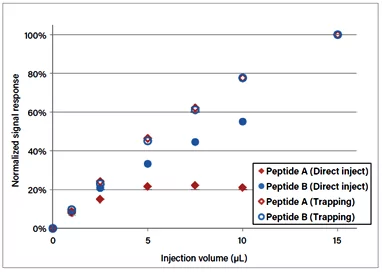
La figure 2 montre comment le débit et la durée de piégeage, et donc le volume global de piégeage qui en résulte, affectent la récupération des peptides lorsqu'on utilise une concentration de solvant. Lorsque l'échantillon est piégé avec un volume trop important, les risques de perte des peptides hydrophiles augmentent considérablement.

La modification de la composition du solvant peut également avoir un impact sur la récupération des peptides, les solvants les plus forts étant plus enclins à laver les peptides faiblement retenus.

L'optimisation de la méthodologie de piégeage ne doit pas être une étape négligée lors du développement d'une méthode de piégeage et d'élution pour les analyses LC-MS en nano- ou micro-courant. Il est bénéfique que vous compreniez la rémanence et la sélectivité globales des phases stationnaires de la colonne de piégeage ainsi que de la colonne d'analyse. Une méthode de piégeage et d'élution bien ajustée augmentera la gamme dynamique de votre méthode puisqu'elle vous permettra d'injecter beaucoup plus d'échantillon et augmentera également la sensibilité globale de l'analyse en raison de la diminution des effets de matrice.
Ressources supplémentaires :
- Qu'est-ce que le microflow LC
- Microflow LC offre une meilleure sensibilité grâce à la réduction des effets de matrice
- Colonnes LC Nano et Micro de Waters
- Livre blanc : Considérations pour la sélection des phases stationnaires optimales pour la nanochromatographie protéomique de type "Trap-and-Elute".
- Vous voulez approfondir le sujet ? Regardez notre récent webinaire organisé par SelectScience, Considerations for Selecting the Optimal Stationary Phases for Proteomic Trap-and-Elute NanoLC-MS, avec Moon Chul Jung, Ph.D., de Waters.
Sujets populaires
ACQUITY QDa (16) bioanalyse (11) produits biologiques (14) biopharma (26) biopharmaceutique (36) biosimilaires (11) biothérapeutique (16) étude de cas (16) chromatographie (14) intégrité des données (21) analyse alimentaire (12) HPLC (15) LC-MS (21) chromatographie liquide (LC) (19) détection de masse (15) spectrométrie de masse (MS) (54) développement de méthodes (13) STEM (12)


