Les colonnes ont aussi leur importance : Choisir la meilleure phase stationnaire pour le NanoFlow et le Microflow LC-MS

Partie 2 : Prise en compte des phases stationnaires pour les configurations de type "piège et élution".
Dans la première partie de cette série, j'ai passé en revue les mécanismes de base, les avantages et les considérations à prendre en compte lors de la mise en œuvre du piégeage dans un flux de travail protéomique. Le défi volumétrique de la LC-MS en nano- ou micro-flux et sa configuration piège-élute jouent un rôle vital lors de la mise en place de la séparation protéomique.
Le volume et la direction de l'élution peuvent tous deux provoquer un élargissement de la bande, ce qui peut détériorer la chromatographie. C'est pourquoi je souhaite discuter ici de l'impact de la rémanence et des caractéristiques des phases stationnaires pour les séparations protéomiques en phase inversée et de la manière dont vous pouvez les utiliser à votre avantage.
- Partie 1 : Comment améliorer la protéomique LC-MS en nano- et micro-flux en considérant la séparation elle-même
- Partie 2 : Choisir la meilleure phase stationnaire pour les LC-MS NanoFlow et Microflow
- Partie 3 : Optimiser les conditions de piégeage
Les avantages de la focalisation d'un échantillon
Comprendre la rémanence de vos phases stationnaires utilisées dans une configuration de type "trap-and-elute" pour la séparation des peptides vous donnera un avantage significatif lors de l'optimisation de votre méthode. La différence de rétentivité est la base des séparations chromatographiques par appel.
La rémanence des peptides est influencée par de nombreux facteurs :
- Phase mobile
- Chaque aspect de la phase stationnaire (propriétés des particules de base, ligand, etc.)
- Les caractéristiques de l'analyte et la façon dont il interagit avec la phase stationnaire.
En chromatographie en phase inversée, les peptides hydrophiles ne se retiennent pas très bien sur une phase stationnaire C18, tandis que les peptides hydrophobes sont fortement retenus et éluent plus tard dans la séparation. La rétentivité hydrophobe est donc le facteur décisif pour séparer différents peptides.
Pour optimiser davantage la séparation et garantir la meilleure capacité de pic de la séparation LC nanoflow délivrée au MS, la dispersion du pic doit être minimisée. Cet effet négatif de l'élargissement du pic peut être atténué par un "effet de recentrage", où les analytes injectés sont fortement retenus à l'entrée de la colonne et forment une bande étroite.
Afin de focaliser un volume d'échantillon injecté, la phase stationnaire doit être capable de retenir les analytes d'intérêt au début du gradient. Lors d'une séparation par piégeage et élution, la phase stationnaire de la colonne analytique doit être plus rétentive que la phase stationnaire de la colonne de piégeage afin de refocaliser. Pour obtenir des connaissances de base sur la théorie impliquée, je vous recommande de lire l'introduction à la HPLC de Waters.
Les prétendants
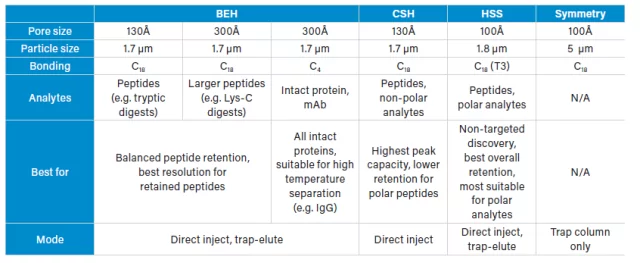
Avant d'entrer dans le détail des séparations peptidiques et de la rémanence, je voudrais présenter brièvement les phases stationnaires que nous utilisons généralement pour les séparations peptidiques en bioanalyse peptidique et en quantification des peptides et des protéines en général.
L'hybride d'éthylène ponté (BEH) et l'hybride à surface chargée (CSH) sont des phases stationnaires basées sur la même particule de base. La particule CSH a une charge de surface positive, ce qui lui confère des propriétés différentes de celles de la particule BEH pour la séparation des peptides. La silice haute résistance (HSS ) offre la rémanence et la sélectivité d'une particule à base de silice pour une utilisation à des pressions plus élevées où les particules de silice traditionnelles auraient mécaniquement échoué. Enfin, il existe des colonnes pièges Symmetry, également à base de silice.
En quoi tout cela est-il pertinent pour votre séparation peptidique ? Continuons.
Rétention des peptides
Nous avons examiné la rétention des peptides des phases stationnaires courantes utilisées dans les colonnes nanoEase M/Z et les iKeys. Pour ce faire, nous avons injecté un mélange de peptides dans des conditions de gradient et suivi la chromatographie de 12 peptides individuels. Le pourcentage d'acétonitrile nécessaire pour éluer chacun des 12 peptides a été comparé et nous a montré les différences de rémanence pour chacune des phases.

En regardant les phases stationnaires individuelles, nous pouvons discerner l'hydrophobie des peptides individuels. Au premier coup d'oeil, vous pouvez également différencier la rétentivité des phases stationnaires individuelles. C'est déjà un grand ensemble de données à avoir.
Si l'on simplifie encore ce graphique et que l'on calcule la moyenne des pourcentages de substances organiques (acétonitrile, ACN) nécessaires pour éluer les 12 peptides, on obtient une image très simple mais compréhensible.
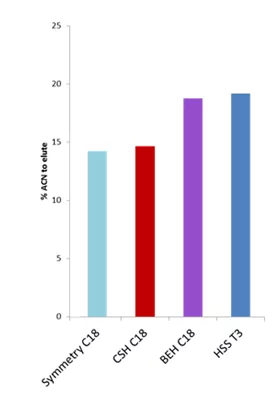
Ce graphique nous montre que Symmetry C18, le matériau utilisé dans les colonnes pièges, présente - en moyenne - la plus faible rétention de peptides de toutes les phases. Le BEH C18 et le HSS T3 nécessitent environ 5 % d'acétonitrile en plus que le Symmetry pour éluer les peptides. C'est une excellente nouvelle.
Supposons que nous éluions un analyte d'un piège Symmetry C18 à 15% d'acétonitrile. Le même analyte dans la même phase mobile (15% d'acétonitrile) sera toujours retenu sur une colonne nanoLC analytique BEH C18 ou HSS T3 en aval pour bénéficier de l'effet de refocalisation. Il en résultera une excellente chromatographie et des pics bien séparés, ce qui conduira à davantage d'identifications de protéines et de peptides.
Mais, en y regardant de plus près, cela suggère également que le CSH, une phase stationnaire avec une excellente chargeabilité et une forme de pic pour les peptides, n'est peut-être pas le meilleur candidat pour la protéomique de type "trap-and-elute". C'est pourquoi je recommande généralement d'utiliser la CSH pour les séparations de peptides par injection directe.
Bien sûr, rien de tout cela n'est absolument vrai pour chaque composé de votre échantillon, mais c'est un point de départ fantastique pour choisir la bonne phase stationnaire pour un projet de protéomique.
Plus de détails
En substance, nous avons constaté que la possibilité de coupler différentes phases stationnaires pour répondre au mieux aux besoins de votre séparation est un avantage significatif et peut avoir un impact très positif sur vos résultats.
Il y a beaucoup plus à dire sur les détails de cette situation et sur ce qu'elle signifie pour votre analyse LC-MS en nanoflux pour la protéomique. Mon collègue Moon Chul Jung a résumé toutes ses conclusions et comparaisons dans un excellent livre blanc sur le choix de la bonne phase stationnaire pour la LC-MS nano- et micro-flux pour la protéomique.
De plus, au cas où vous l'auriez manqué, j'ai écrit un court article sur les mécanismes généraux de piégeage tels que l'élution par piège avant et arrière.
Ressources supplémentaires
- Qu'est-ce que le microflow LC
- Les colonnes ont aussi leur importance : comment améliorer la protéomique LC-MS à nano- et micro-débit en tenant compte de la séparation elle-même
- Microflow LC offre une meilleure sensibilité grâce à la réduction des effets de matrice
- Colonnes LC Nano et Micro de Waters
- Livre blanc : Considérations pour la sélection des phases stationnaires optimales pour la nanochromatographie protéomique de type "Trap-and-Elute".
- Vous voulez approfondir le sujet ? Regardez notre récent webinaire organisé par SelectScience, Considerations for Selecting the Optimal Stationary Phases for Proteomic Trap-and-Elute NanoLC-MS, avec Moon Chul Jung, Ph.D., de Waters.
Sujets populaires
ACQUITY QDa (16) bioanalyse (11) produits biologiques (14) biopharma (26) biopharmaceutique (36) biosimilaires (11) biothérapeutique (16) étude de cas (16) chromatographie (14) intégrité des données (21) analyse alimentaire (12) HPLC (15) LC-MS (21) chromatographie liquide (LC) (19) détection de masse (15) spectrométrie de masse (MS) (54) développement de méthodes (13) STEM (12)