Une vue de l'industrie biopharmaceutique en Asie - un entretien avec Ken Fountain
Ken Fountain, directeur du développement de l'activité biopharmaceutique chez Waters, est récemment rentré d'un voyage éclairant en Asie, où il a rendu visite aux clients de Waters en Corée du Sud et assisté au China Biopharma Executive Summit à Shanghai, dont Waters était l'un des sponsors. Nous l'avons rencontré et lui avons demandé de nous faire part de ses réflexions sur l'industrie biopharmaceutique en Asie.
Q : D'après les conversations et les observations faites pendant votre voyage, quelle est la force de l'industrie biopharmaceutique en Asie ?
R : L'Asie est un important moteur de croissance pour les industries pharmaceutiques et biopharmaceutiques. En Chine et en Corée du Sud notamment, l'accent est mis sur le développement des biosimilaires. Plusieurs médicaments biosimilaires ont déjà été fabriqués et mis sur le marché dans ces pays. La région déploie beaucoup d'efforts pour faire progresser les biosimilaires et autres produits biologiques.
En fait, cette évolution est si rapide que, selon certaines estimations, les ventes futures de ces biosimilaires seront supérieures à celles des médicaments génériques à petites molécules. Certains médicaments, tels que les conjugués anticorps-médicaments (ADC), font maintenant l'objet de biosimilaires, même si leurs brevets n'expireront pas avant des années.
Nous constatons également que de nombreuses entreprises pharmaceutiques mondiales s'associent à des institutions universitaires et à des entreprises biopharmaceutiques locales dans cette région. Elles établissent des centres d'innovation et des installations de fabrication afin d'accélérer le développement et l'approbation des biosimilaires, ce qui contribue également à la croissance rapide de l'Asie dans ce secteur.
Q : Qu'avez-vous appris d'autre sur les efforts de la région pour faire progresser les biosimilaires et autres produits biologiques ?
R : La discussion la plus importante porte probablement sur la réglementation. Quelles seront les directives réglementaires qui définiront la "similarité" d'un biosimilaire, à la fois dans les pays et sur le marché mondial ? Le résultat de ces discussions déterminera la voie réglementaire pour les biosimilaires produits et commercialisés pour la population locale par rapport à ceux produits pour la vente en Europe et en Amérique.
En Chine, la réglementation relative aux produits biologiques évolue très rapidement pour s'aligner sur les normes d'harmonisation mondiales. Outre les travaux sur les biosimilaires, j'ai mentionné qu'un certain nombre d'entreprises pharmaceutiques mondiales et locales s'associent pour développer de nouveaux médicaments. À cette fin, la FDA chinoise met en place une procédure d'examen accélérée. En outre, le gouvernement chinois investit massivement dans les efforts de découverte précoce. Les efforts primaires sont axés sur une meilleure médecine pour la population chinoise.
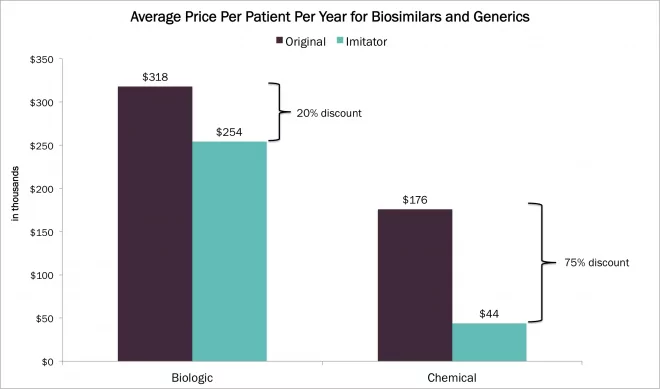
L'industrie biopharmaceutique est assez bien établie en Corée du Sud, le premier biosimilaire d'anticorps au monde, Remsima, produit par Celltrion, y ayant été approuvé en 2013(voir la note d'application Waters correspondante). Il existe un partenariat solide entre l'industrie privée et le gouvernement avec des laboratoires d'essais centraux qui fournissent des services de caractérisation ainsi que des services de validation pour les nouvelles technologies, qui peuvent être adoptés dans les réglementations.
Récemment, la société coréenne Samsung Biologics a révélé son objectif de devenir le plus grand fabricant de médicaments biologiques au monde d'ici 2020. De nombreux articles ont été consacrés au dernier investissement de Samsung dans les produits biopharmaceutiques, récemment couronné par l 'approbation par Samsung Bioepis de son biosimilaire Enbrel en Corée du Sud et en Europe(voir la note d'application Waters correspondante). Ces efforts pourraient avoir des conséquences importantes pour l'industrie, notamment en ce qui concerne la structure de prix mondiale des médicaments biosimilaires, qui sont actuellement vendus environ 25 % moins cher que les produits de référence.
Q : Quelles sont les innovations et les avancées technologiques les plus intéressantes que vous ayez vues en Asie ?
R : En raison de la nécessité d'une caractérisation complète des produits biologiques pour prouver leur similarité avec les produits de référence(voir le webinaire Waters à ce sujet), la Corée du Sud et la Chine investissent dans un grand nombre des technologies utilisées par les entreprises pharmaceutiques occidentales, à savoir la chromatographie liquide, la spectrométrie de masse et l'électrophorèse capillaire. Ces technologies comprennent la spectrométrie de masse à haute résolution pour la caractérisation chimique et structurelle approfondie, qui sont des paramètres clés pour déterminer la similarité de ce qu'ils produisent par rapport aux produits de référence.
Alors que l'industrie biopharmaceutique s'intéresse de près aux innovations en matière de fabrication et de conception des installations, l'Asie est l'un des principaux endroits où ces nouvelles conceptions d'installations sont testées et mises en œuvre.
En ce qui concerne la production, le géant biopharmaceutique Amgen a ouvert une usine de fabrication à usage unique à Singapour en 2014. Ces usines consomment moins d'énergie et d'eau que les usines classiques, mais produisent la même quantité. Elles sont plus petites, plus flexibles et permettent d'économiser sur les coûts d'exploitation.
Q : Les marchés asiatiques vont-ils influencer le développement biopharmaceutique dans le monde ?
R : Je pense que le marché asiatique a déjà prouvé son importance pour l'industrie. Comme je l'ai mentionné, plusieurs médicaments biologiques - beaucoup des biosimilaires sur le marché aujourd'hui - ont été développés et commercialisés en Asie, parfois à un rythme record. Le développement des biosimilaires s'accélère, et l'Asie joue un rôle essentiel dans les discussions sur les prix et les orientations réglementaires.
À l'avenir, l'Asie sera un acteur clé en tant que moteur du développement de nouveaux médicaments, des technologies nécessaires à leur caractérisation et des avancées en matière de production de produits biologiques et de tests de libération.
Q : Que fait Waters dans le domaine des biosimilaires ?
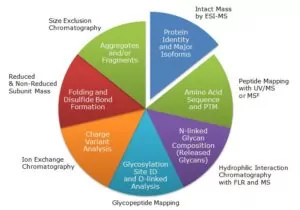
R : Depuis un certain temps, Waters applique ses capacités de caractérisation biothérapeutique au domaine des biosimilaires, notamment en ce qui concerne la détermination de la similarité.
Actuellement, nous travaillons avec les agences de réglementation et les développeurs et fabricants de médicaments biosimilaires pour comprendre les prochains défis auxquels ils sont confrontés, et comment la technologie Waters peut relever ces défis pour aider à mettre ces médicaments sur le marché plus rapidement. Cela inclut l'éducation sur ce que sont les biosimilaires, comment la similarité est définie, et ce que la LC-MS peut faire pour aider à accélérer le développement et la commercialisation des biosimilaires.
En 2016, nous lancerons des applications pour les impuretés (par exemple, les protéines des cellules hôtes) et l'analyse des structures d'ordre supérieur sur les biosimilaires d'anticorps monoclonaux (mAb), ainsi que l'utilisation de solutions basées sur la LC-MS pour l'évaluation de la similarité des médicaments biosimilaires non mAb tels que l'insuline et l'érythropoïétine (EPO).
For more information on Waters technologies and tools for biosimilar analysis, please visit legacy-stage.waters.com/biosimilars.
Suivez Ken sur Twitter : @mAb_dude
Sujets populaires
ACQUITY QDa (16) bioanalyse (11) produits biologiques (14) biopharma (26) biopharmaceutique (36) biosimilaires (11) biothérapeutique (16) étude de cas (16) chromatographie (14) intégrité des données (21) analyse alimentaire (12) HPLC (15) LC-MS (21) chromatographie liquide (LC) (19) détection de masse (15) spectrométrie de masse (MS) (54) développement de méthodes (13) STEM (12)


