¿Dónde ha ido mi muestra?

Un caso de unión no específica (NSB)
Todos hemos pasado por eso. Pasas horas (a veces días) en el laboratorio preparando tus muestras. Las lleva cuidadosamente al automuestreador, carga con cariño la cola de muestras y pulsa el botón de reproducción. Por supuesto, las ejecutas durante la noche porque el tiempo del instrumento es precioso y alguien tiene que utilizarlo mañana. Llega al laboratorio por la mañana y se instala inmediatamente para procesar sus datos.
Y no hay nada allí.
¿Olvidó inyectarse? No. ¿Tal vez no te inyectaste el analito en absoluto? Estás empezando a cuestionar tu cordura.
"Entonces, ¿a dónde fue mi muestra?"
Si está seguro de no haber cometido los errores habituales (que todos cometemos), y sabe que su muestra debería estar ahí, pero no lo está, ¿a dónde ha ido a parar?
Los péptidos y las proteínas son especialmente propensos a la unión no específica (NSB) o a la adsorción a superficies sólidas. Estas superficies pueden ser puntas de pipeta, contenedores de almacenamiento de muestras o agujas de inyección. Ahora bien, todos conocemos formas de mitigar la adsorción, como:
- utilizando proteínas portadoras (que pueden añadir complejidad no deseada a nuestras muestras) o
- utilizar materiales de laboratorio con superficies de alto rendimiento para ayudar a evitar que se produzca la adsorción en primer lugar.
Sin embargo, en muchos casos, podemos optar por no abordar el problema.
¿Está preparado para afrontar las consecuencias de la unión inespecífica en su análisis de muestras?
Entre ellas se encuentran:
- Baja recuperación
- Alta variabilidad
- Poca sensibilidad
- Rango dinámico lineal insuficiente
Examinemos más a fondo estas consecuencias.
Baja recuperación
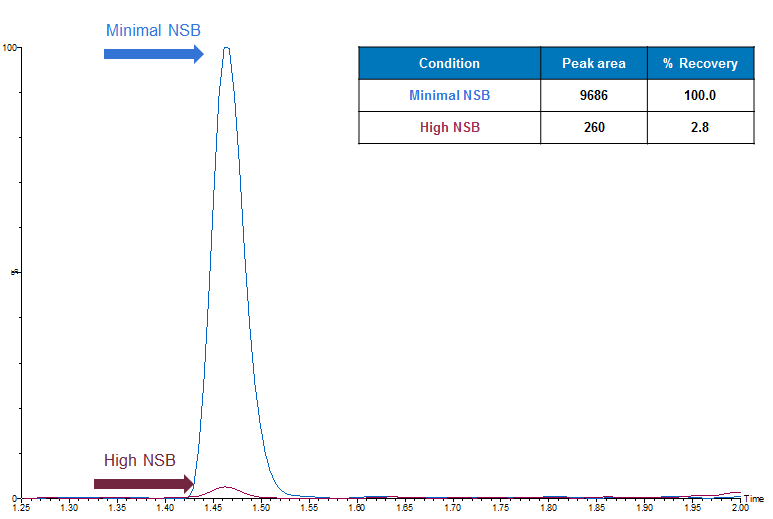
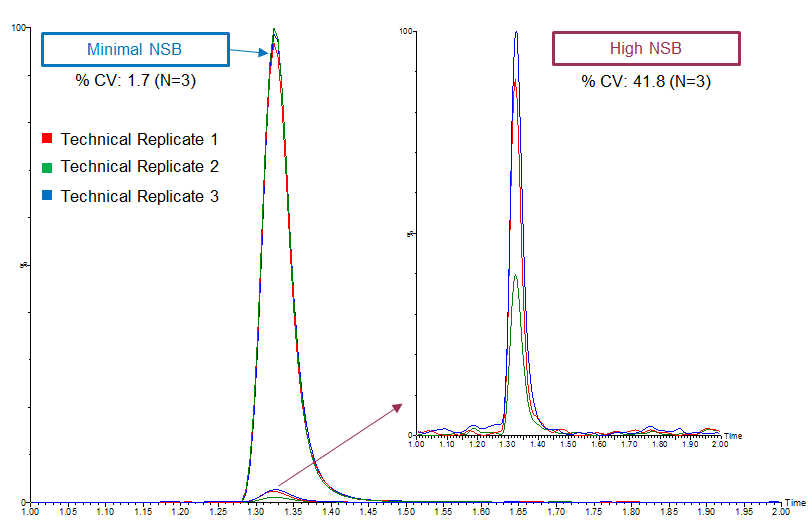
Alta variabilidad
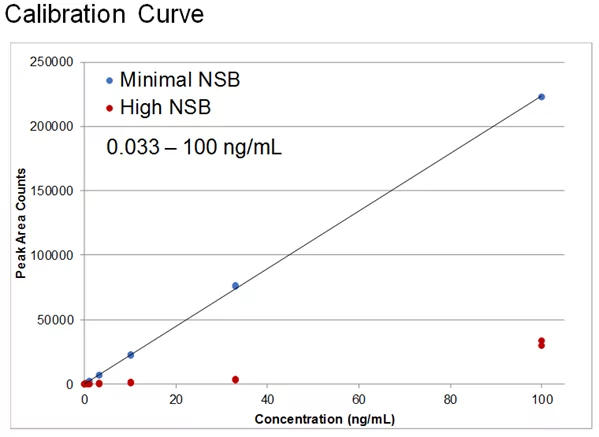
Poca sensibilidad
La próxima vez que entre en el laboratorio y descubra que falta su analito, pregúntese lo siguiente:
"¿He hecho lo suficiente para combatir la unión inespecífica?"
Si no estás seguro, no dudes en pedir ayuda a nuestros científicos de Waters.
Esté atento a la próxima entrada de nuestro blog "Muestras perdidas en el contenedor: la unión no específica y el impacto de los agentes de bloqueo", por el doctor Moon Jung.
Recursos adicionales:
Campo de entrenamiento en bioanálisis de péptidos y proteínas
Temas populares
ACQUITY QDa (16) bioanálisis (11) biológicos (14) biofarmacia (26) biofarmacéutica (36 ) biosimilares (11) bioterapéutica (16) estudio de caso (16) cromatografía (14) integridad de los datos (21) análisis de alimentos (12) HPLC (15) LC-MS (21 ) cromatografía líquida (LC) (19) detección de masas (15) espectrometría de masas (EM) (54 ) desarrollo de métodos (13) STEM (12)