Comprender la complejidad de la muestra: Determinación de los efectos de la matriz en muestras alimentarias complejas

Aunque la combinación de tecnologías cromatográficas y de espectrometría de masas ha revolucionado los laboratorios de análisis de contaminantes alimentarios, uno de los principales inconvenientes es la posibilidad de que se produzcan efectos de matriz. Debido a las interacciones no deseadas entre los analitos y la matriz de la muestra, la respuesta del analito puede verse reducida o amplificada. La influencia de la matriz en la fiabilidad de su método debe determinarse al implementar nuevas metodologías, productos o analitos en el ámbito analítico de su laboratorio.
En el análisis GC-MS, la presencia de sitios activos en los revestimientos y las columnas analíticas puede favorecer la adsorción de determinados grupos funcionales. El exceso de matriz, que suele estar presente en los extractos alimentarios, desactiva estos sitios, por lo que la respuesta del analito puede aumentar en relación con la misma concentración en extractos alimentarios más limpios o basados en disolventes. Este fenómeno se denomina mejora de la señal inducida por la matriz. En el análisis LC-MS, la ionización por electrospray (ESI) sigue siendo la fuente de ionización preferida en los laboratorios de rutina, debido a su amplia capacidad de cobertura de compuestos. Sin embargo, la ESI también es conocida por su significativo impacto en la eficiencia de la ionización en presencia de la matriz, lo que afecta a la fiabilidad de la detección.
Entonces, ¿qué es la matriz? El Libro de Oro de la IUPAC establece simplemente que la matriz es "los componentes de la muestra distintos del analito". [1] Si tenemos en cuenta la variedad de muestras que se reciben en los laboratorios de pruebas rutinarias para los análisis de contaminantes y residuos, desde tomates ácidos hasta aceites comestibles grasos, el alcance de los componentes de la matriz es enorme. Comprender los tipos de productos representativos que su laboratorio puede analizar a lo largo de la vida del método ayuda a orientar los pasos de desarrollo y optimización del método. Para superar el impacto que tiene la matriz en la detección de nuestros analitos de interés, primero debemos determinar su presencia.
Determinación de los efectos de la matriz
Aunque se promueven varias opciones para medir el impacto de la matriz en su análisis, la teoría y la práctica básica es la misma. Estos protocolos incluyen el método de infusión post-columna y la adición post-extracción. [2,3] En este blog, nos centraremos en los protocolos relativos a este último, en el que se compara una concentración conocida de analito en el disolvente con la misma concentración añadida a la(s) muestra(s) tras la extracción. Esta comparación puede llevarse a cabo en réplicas(n=5 como mínimo) a una concentración fija (ecuación 1) o en una serie de calibración (ecuación 2) que cubra un rango de concentración más amplio, en el que todas las muestras deben prepararse con una composición de disolvente similar y adquirirse en las mismas condiciones, dentro de una única ejecución analítica.
Con los datos resultantes se compara, por ejemplo, el área de pico de los analitos:
Ecuación 1: Cálculo del factor de efecto de la matriz
Donde A: respuesta del pico del analito en el estándar del disolvente y B: respuesta del pico del analito en el estándar de la matriz( es decir, añadido a la muestra alimentaria después de la extracción).
Si el resultado es menor que cero (valor negativo), la respuesta del analito está siendo suprimida por la matriz. Si es mayor que cero (valor positivo), la respuesta del analito está siendo potenciada por la matriz. Como regla general, las directrices de las mejores prácticas recomiendan que se tomen medidas para compensar si los efectos son superiores al 20%, minimizando así el error de notificación de concentraciones exactas de los residuos incurridos. [4-6]
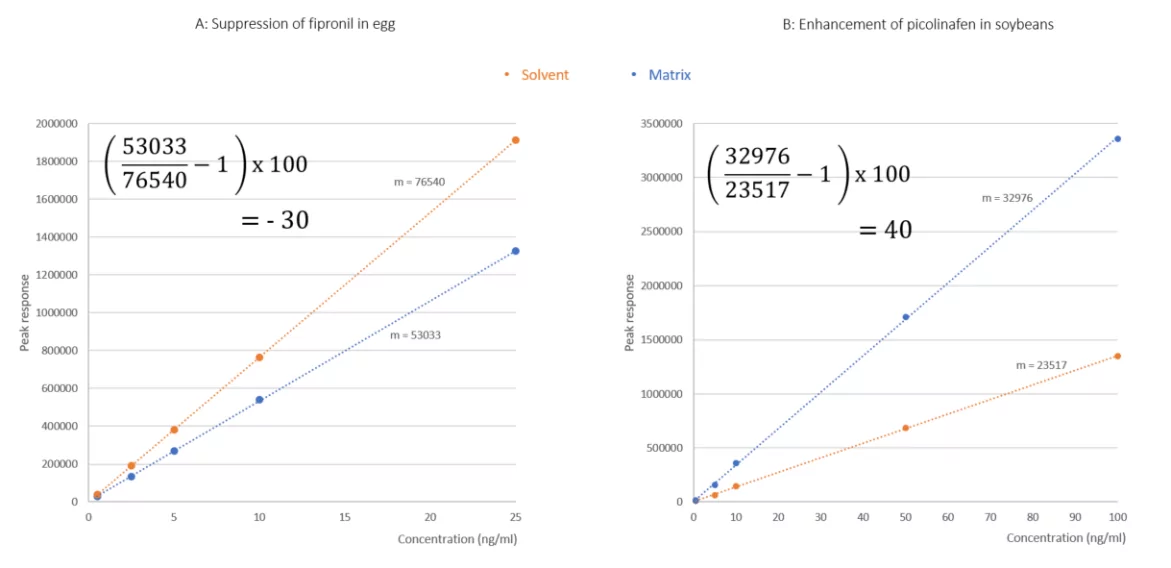
A continuación se muestra una representación gráfica de este cálculo, en la que aparecen los picos cromatográficos de los analitos en el disolvente y en las matrices. En la Figura 1A, se superponen el fipronil tanto en el disolvente (75:25 agua: acetonitrilo) como en la matriz (huevo crudo, extraído con QuEChERS y diluido, 75:25 agua: acetonitrilo). El eje y (respuesta de pico) para ambas inyecciones está unido, mostrando así la supresión del fipronil por la matriz co-extraída de la muestra de huevo. Del mismo modo, en la Figura 1B, se superponen el picolinafeno inyectado en el disolvente y la soja, con el eje y vinculado. En este ejemplo, la respuesta del picolinafeno en la soja es significativamente mayor que en el disolvente. Utilizando la ecuación 1, se determinó una supresión del 30% para el fipronil en el huevo y un aumento del 40% para el picolinafen en la soja. En estos dos ejemplos, sería necesario modificar el método para compensar estos efectos de la matriz y garantizar la cuantificación fiable de los residuos incurridos.

Al igual que en el método anterior, los conjuntos de muestras en disolvente y matriz se generan con la misma composición de disolvente y se adquieren en las mismas condiciones. La principal diferencia en este método es la creación de series de calibración, en lugar de réplicas a una sola concentración. Las series de calibración deben prepararse en el disolvente y la matriz, ambos a las concentraciones correspondientes, en un rango de trabajo apropiado y lineal. Se trazan curvas de calibración individuales para el disolvente y la matriz, informando de la respuesta del pico del analito frente a la concentración conocida. A partir de cada curva, se determina la ecuación de la línea y se compara la pendiente de cada una, de la siguiente manera
Ecuación 2: Cálculo de los efectos de la matriz a partir de la pendiente de la curva
DondemA: pendiente de la línea para la serie de calibración basada en el disolvente y mB: pendiente de la línea para la serie de calibración basada en la matriz.
Tomando los ejemplos del fipronil en el huevo y del picolinafen en la soja ya comentados, sus series de calibración, relativas a los estándares de disolventes, se superponen para su comparación visual. Introduciendo la pendiente calculada de cada curva en cada ecuación, se determinaron de nuevo efectos de matriz de -30% y 40% para el fipronil y el picolinafeno, respectivamente.
Los métodos para la determinación de los efectos de la matriz que se discuten aquí utilizan muestras de la matriz que se han enriquecido después de la extracción, para limitar cualquier variación en la extracción inicial de los analitos de la matriz. Si no extraemos el analito de forma eficiente al principio, podemos achacar la mala detección a los efectos de la matriz, en lugar de a la ausencia del analito en las concentraciones adecuadas. Por supuesto, antes de determinar los efectos de la matriz, es importante tener en cuenta la extractabilidad del analito durante los pasos iniciales de extracción de la preparación de la muestra, si no está ya determinada por métodos de referencia o investigaciones anteriores. Aunque este ejercicio puede llevarse a cabo utilizando estándares basados en disolventes, el uso de tipos de productos representativos proporciona una mejor visibilidad del verdadero rendimiento del método y de las posibles interacciones con la matriz. La eficacia con la que un disolvente puede extraer analitos de la matriz se determina fácilmente de forma similar a los efectos de la matriz:
Ecuación 3: Cálculo de la recuperación de analitos por extracción
Donde A: respuesta del pico del analito en el estándar del disolvente y C: respuesta del pico del analito en el estándar extraído de la matriz( es decir, añadido a la muestra alimentaria antes de la extracción).
Conclusión
Cuando se amplía el alcance del análisis, ya sea la metodología, los analitos o los tipos de productos, es importante comprender la capacidad de extracción de los analitos de la matriz y el efecto que tiene la matriz coextruida en la detección del analito. Estos factores pueden determinarse fácilmente a partir de la adquisición de varias muestras de disolvente y de alimentos con puntas, en las que la composición del disolvente y los parámetros de adquisición deben ser constantes, para garantizar que toda la variabilidad se debe únicamente a la matriz. Una vez que se ha determinado el efecto de la matriz en la detección del analito, los valores que significan más de un 20% de supresión o mejora suelen requerir medidas para compensar estos efectos. En nuestro próximo blog sobre soluciones para superar la complejidad de la matriz, explicaremos cuáles son las mejores acciones para su laboratorio.
Referencias/fuentes de información:
[1] Libro de Oro de la IUPAC, Compendio de Terminología Química de la Unión Internacional de Química Pura y Aplicada, 2019.
[2] M. Twohig, J. Mather, A. Hooper, A Tool for Robust Analytical Methods Development, Waters' Application Note, 2010.
[3] B.K. Matuszewski, M.L. Constanzer, C.M. Chavez-Eng, Strategies for the Assessment of Matrix Effect in Quantitative Bioanalytical Methods Based on HPLC-MS/MS, Anal Chem. 75, 13, 2003.
[4] Red EURL de Plaguicidas, Procedimientos de control de calidad analítica y validación de métodos para el análisis de residuos de plaguicidas en alimentos y piensos, SANTE/12682/2019, 2019.
[5] US FDA, Guidelines for the Validation of Chemical Methods in Food, Feed, Cosmetics, and Veterinary Products, 3rd Edition, 2019.
[6] LGC National Measurement System, Guide to achieving reliable quantitative LC-MS measurements, primera edición, 2013.
[7] Eurachem, The Fitness for Purpose of Analytical Methods A Laboratory Guide to Method Validation and Related Topics, segunda edición, 2014.
Temas populares
ACQUITY QDa (16) bioanálisis (11) biológicos (14) biofarmacia (26) biofarmacéutica (36 ) biosimilares (11) bioterapéutica (16) estudio de caso (16) cromatografía (14) integridad de los datos (21) análisis de alimentos (12) HPLC (15) LC-MS (21 ) cromatografía líquida (LC) (19) detección de masas (15) espectrometría de masas (EM) (54 ) desarrollo de métodos (13) STEM (12)



