Herramientas para el éxito cromatográfico: Tres formas de apoyar la calidad de los datos en el análisis de rutina


Evitar las trampas de la calidad y la integridad de los datos en el laboratorio de control de calidad de la industria farmacéutica mientras se realizan los análisis de rutina es un desafío constante. Las infracciones reglamentarias son con frecuencia el resultado de la falta de datos completos, datos sospechosos y pistas de auditoría inadecuadas. Un informe reciente de Deloitte En el informe de la Comisión Europea se afirma que las violaciones de la integridad de los datos representan más del 70% de las cartas de advertencia emitidas en todo el mundo.
La correcta integración de los picos cromatográficos en apoyo de la calidad y la integridad de los datos es objeto de importantes investigaciones durante las auditorías reglamentarias. Un enfoque para satisfacer las expectativas de los reguladores de "acertar a la primera" cuando auditan las prácticas de integración de picos es modernizar y mejorar el rendimiento de sus análisis cromatográficos. Sin embargo, los costes de validación de métodos y licencias reglamentarias aumentan a medida que disminuyen los presupuestos de los laboratorios, lo que puede disuadirle de realizar cambios sustanciales en sus métodos.
Vea el seminario web de Heather Longden y la Dra. Paula Hong aquí.>>
¿Qué sencillas mejoras en el método puede hacer para que los revisores confíen más en el cumplimiento de sus datos y, al mismo tiempo, le faciliten la vida?
A continuación se presentan tres maneras de abordar los retos cromatográficos más comunes en su análisis farmacéutico rutinario y avanzar en su éxito.
1. Conseguir una integración precisa de los picos a la primera
A menudo, los reguladores consideran que los métodos de prueba son inadecuados para demostrar la pureza de los medicamentos. ¿Por qué? En parte porque los analistas se esfuerzan por conseguir una integración precisa de los picos a la primera. En una observación reglamentaria específica comunicada por la FDA, se descubrió que los datos se habían reprocesado hasta 12 veces, y que sólo se incluía el resultado final en el informe para su revisión por parte de Control de Calidad.
Este tipo de ocurrencia desencadena preocupaciones sobre si los datos asegurados o presentados estaban realmente completos. Es muy común y científicamente correcto optimizar los parámetros de integración de los picos; sin embargo, la citada observación reglamentaria se interpretó como una amplia manipulación de los datos, especialmente cuando la respuesta del responsable fue que era típico jugar con los parámetros de integración. Hubo una marcada incoherencia en cuanto a la integración de impurezas de bajo nivel en los cromatogramas entre los usuarios. Además, la ausencia de un protocolo aprobado para la integración manual dio lugar a diferencias en los resultados de los picos. Estos tipos de métodos de ensayo pueden conducir a una integración inconsistente de los picos coeluyentes. La integración incoherente de los picos y los métodos analíticos inadecuados pueden llevar a que no se detecten las impurezas, lo que da lugar a la salida al mercado de productos farmacéuticos adulterados.
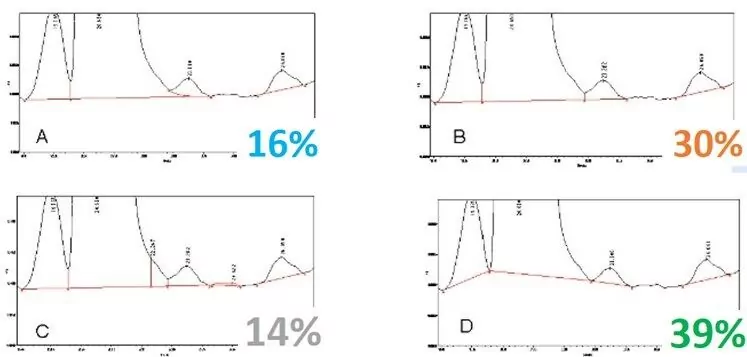
¿Cuál es el pico de integración adecuado? Aquí están las respuestas a una encuesta reciente:
La mayoría de los encuestados seleccionaron D, que es común y fácil de hacer, pero si las alturas de los picos cambian, la altura del valle cambia, y las áreas cambian dramáticamente. D subestima la cantidad de la impureza, mientras que C la sobreestima. A y B son probablemente las mediciones más precisas de las áreas de los picos, y A integra con mayor exactitud la impureza.
2. Entender cómo se pueden hacer cambios en sus métodos analíticos sin requerir la aprobación previa de la normativa
Si se puede mejorar el método para que no sea demasiado pesado, se puede reducir la manipulación manual. Esto, en última instancia, reduce cualquier preocupación que los reguladores puedan tener sobre la integridad de los datos, como la sospecha de que los datos hayan sido manipulados para cumplir con la normativa.
Una causa común de preocupación por la integridad de los datos es que los métodos analíticos elegidos suelen ser antiguos y no se han modernizado desde su desarrollo inicial. Esto puede hacer que sean inadecuados para su uso en un laboratorio analítico moderno.
Los esfuerzos de los reguladores mundiales y de la Conferencia Internacional de Armonización (ICH) dibujan una perspectiva positiva para facilitar los cambios posteriores a la aprobación para mejorar los métodos analíticos. El enfoque del ciclo de vida del producto - ICH Q12 incluye específicamente ejemplos sobre cómo se pueden realizar cambios en los métodos analíticos sin que se requiera una aprobación previa reglamentaria. Además, los reguladores mundiales y la ICH están trabajando en una nueva guía en el Desarrollo de Métodos Analíticos - ICH Q14, que busca incorporar más conocimientos en la presentación de un método analítico. Además, un equipo de trabajo de la ICH está revisando la Validación de Métodos - ICH Q2 (R2) para cubrir la validación mejorada y la validación de técnicas analíticas modernas.
Es fundamental contar con métodos robustos que se ejecuten de forma fiable en sistemas de alto rendimiento para mitigar los fallos de idoneidad del sistema.
Esto es lo que opinan los encuestados recientemente sobre los fallos en las pruebas de sistemas y las transferencias de métodos:
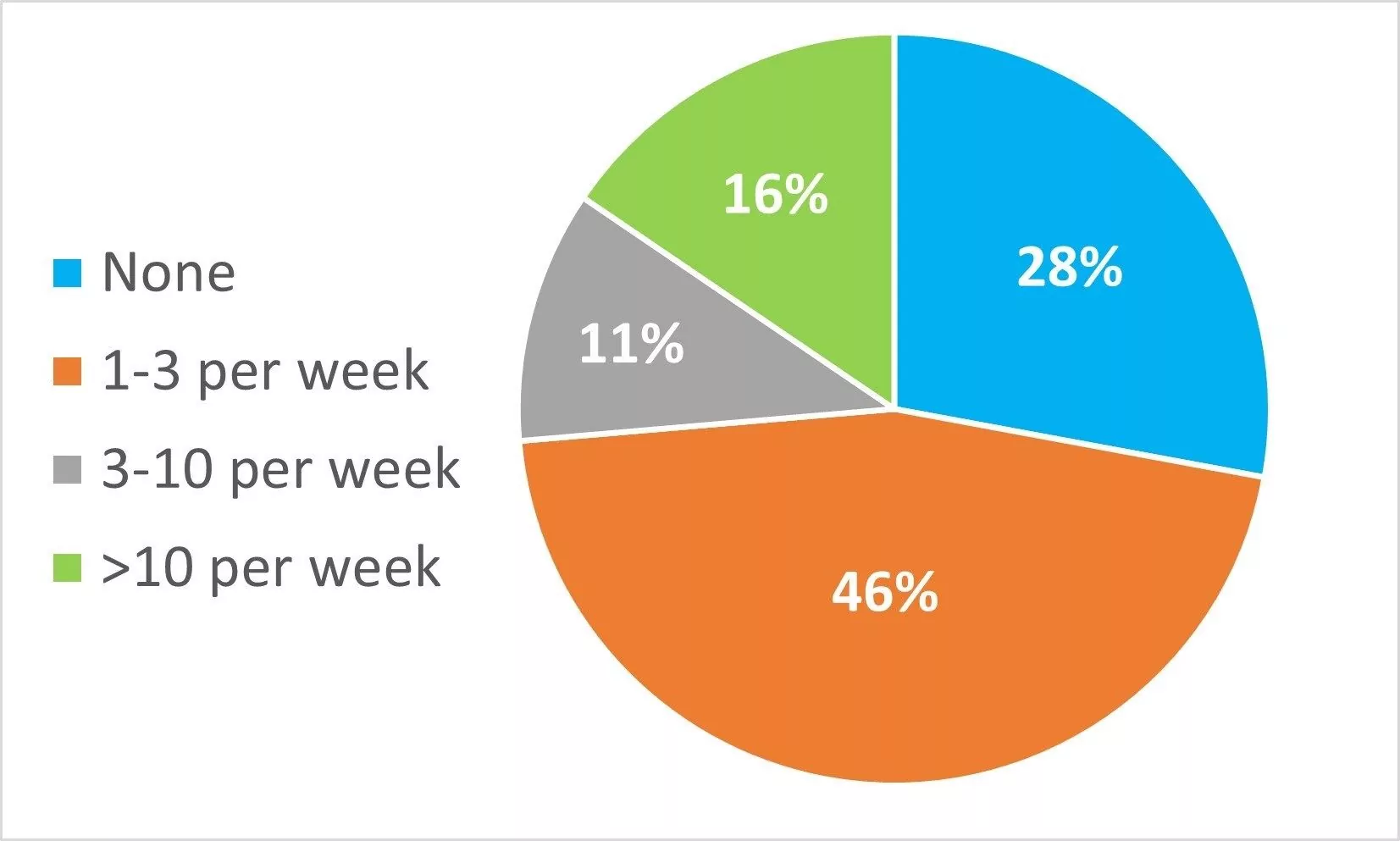
En su laboratorio, ¿cuántos juegos de muestras a la semana hay que invalidar y repetir porque el sistema falla en la prueba adecuada?
Sólo el 28% declaró que rara vez tenía que invalidar y repetir los resultados y el 16% declaró que había que invalidar y repetir más de 10 conjuntos de muestras a la semana, lo que suponía una importante pérdida de tiempo y costes.
Cuando se transfieren métodos al control de calidad, ¿se suele:
Para mejorar el éxito de la transferencia de métodos, la mayoría de los encuestados indicaron que utilizan como criterio los tiempos de retención relativos. Sin embargo, también hay un número importante de laboratorios que aprovechan los problemas de transferencia de métodos para modernizarlos.
3. Asegúrese de que su sistema HPLC está a la altura de las circunstancias
Con su capacidad de mejorar el rendimiento el sistema Arc HPLC está diseñado para afrontar los principales retos cromatográficos. Con la capacidad de ejecutar tanto los métodos de HPLC existentes como los métodos mejorados en columnas de HPLC de tamaño de partícula más pequeño, como las de 3,5 µm, el sistema ofrece inyecciones altamente reproducibles y precisas para que pueda estar seguro de que cumplirá sus especificaciones de desviación estándar relativa (RSD) sin tener que volver a ejecutar sus muestras. Esto elimina la necesidad de optimizar constantemente los parámetros de integración de los picos y reduce el tiempo que se dedica a investigar los resultados anormales.
El nuevo sistema Arc HPLC de Waters le ofrece una actualización sin fisuras de los sistemas cuaternarios y binarios heredados, con una calidad de separación y unos tiempos de retención comparables. La actualización a un sistema moderno como el Arc HPLC le garantiza la mejora de los métodos existentes al proporcionar más flexibilidad y aumentar la eficiencia, con una mayor precisión de inyección y límites de contrapresión.
Las mejoras en el rendimiento y la solidez de los instrumentos de HPLC también pueden contribuir a la mejora general de la calidad e integridad de los datos. Los criterios de idoneidad del sistema para los métodos de rutina se alcanzan fácilmente, incluso para las monografías USP. Y no sólo eso, el Arc HPLC también implementa una mayor tolerancia a la contrapresión para ofrecerle la flexibilidad de utilizar caudales elevados con columnas de partículas más pequeñas, reduciendo el tiempo de ejecución, los costes y el consumo de fase móvil y, lo que es más importante, logrando una mayor resolución y sensibilidad de los picos. Los instrumentos modernos, como el sistema Arc HPLC, están diseñados para proporcionar reproducibilidad a los gradientes poco profundos de HPLC, como los que se suelen utilizar en muchos métodos regulados (USP).
El momento de realizar mejoras es ahora, ya que son inminentes las nuevas oportunidades normativas para la gestión de cambios posteriores a la aprobación. Las directrices actualizadas influirán en la forma de desarrollar y documentar los métodos cromatográficos, lo que dará lugar a un mayor examen y supervisión de los requisitos de idoneidad y reproducibilidad del sistema para reducir el error de medición y garantizar aún más la calidad general de los datos.
Encontrar formas de mejorar fácilmente sus métodos y garantizar un análisis "correcto a la primera" le proporciona una mayor confianza en sus datos y la seguridad de que los reguladores confían en los resultados que presenta o envía. Aprovechar a Waters como socio de confianza ayuda a garantizar el éxito en todas las áreas del análisis de rutina.
Heather Longden, Directora de Marketing, Inteligencia Farmacéutica, Waters Corporation
Paula Hong, PhD, Científica Consultora Principal, Waters Corporation
¿Quiere saber más?
Vea el seminario web a la carta de Heather y Paula: Garantizar la calidad de los datos y afrontar los retos cromatográficos en el análisis farmacéutico de rutina: Herramientas para el éxito
Además, a continuación encontrará más recursos de expertos para su análisis por HPLC:
- Mesa redonda: Las nuevas directrices y las modernas soluciones cromatográficas convergen para garantizar la calidad de los datos en el laboratorio farmacéutico: Perspectivas de la USP y la MHRA
- Artículo: Un paso sencillo para mejorar su análisis rutinario por HPLC
- Resumen de la aplicación: Transferencia de método de un gradiente rápido desde un HPLC binario a un sistema HPLC Arc
- Resumen de la aplicación: Sistema Arc HPLC: Mejora de la productividad y transferencia sin fisuras de un método de impurezas HPLC
Temas populares
ACQUITY QDa (16) bioanálisis (11) biológicos (14) biofarmacia (26) biofarmacéutica (36 ) biosimilares (11) bioterapéutica (16) estudio de caso (16) cromatografía (14) integridad de los datos (21) análisis de alimentos (12) HPLC (15) LC-MS (21 ) cromatografía líquida (LC) (19) detección de masas (15) espectrometría de masas (EM) (54 ) desarrollo de métodos (13) STEM (12)