Muestras perdidas en el contenedor: La unión no específica y el impacto de los agentes bloqueadores

Mi muestra se quedó en la solución... ¿o no?

¿Qué ha pasado con mi preciosa muestra?
Esta unión inesperada a la superficie se denomina unión no específica (NSB) o adsorción no específica (NSA). Estos términos proceden originalmente de los ensayos de unión de ligandos, en los que se espera que un analito sea captado sólo a través de la interacción específica entre el analito y sus receptores. Todas las demás uniones se denominan no específicas. En la actualidad, los términos NSB y NSA se utilizan para describir cualquier interacción de unión que no se haya previsto y la consiguiente pérdida de analito.
El NSB puede arruinar un experimento bien planificado. Puede dar lugar a resultados cuantitativos inexactos o, lo que es peor, puede que no se obtenga ninguna señal.
¿Cómo se puede evitar este problema y es eficaz?
Este problema de los INN no es en absoluto nuevo. Es ampliamente conocido por los científicos biológicos que llevan mucho tiempo trabajando con proteínas y péptidos. Para evitar este problema, los científicos han ideado muchas soluciones basadas en estos dos principios:
- Principio 1 - Cambiar el entorno químico para eliminar o reducir las interacciones no deseadas.
- Cambiar el pH de la solución para reducir las interacciones iónicas
- Añadir sales para modificar la fuerza iónica
- Añadir un disolvente orgánico a la solución
Dado que cada analito es químicamente único, no existe una condición única que pueda aplicarse a todas las muestras. Además, cambiar el pH o añadir un disolvente orgánico puede alterar las propiedades de la biomolécula, como su estado de carga o su estructura plegada. La adición de sal a la muestra puede favorecer la supresión de iones en la detección por EM.
- Principio 2 - Añadir un agente de bloqueo para cubrir los sitios potenciales de NSB en la superficie.
- Añadir polímeros como el PEG
- Añadir detergentes como Tween-20 o Triton X-100
- Añadir proteínas portadoras como la albúmina de suero bovino (BSA) o la caseína
Añadir un agente de bloqueo es básicamente volver a añadir impurezas a las muestras limpiadas. Los detergentes y los polímeros de gran tamaño son especialmente perjudiciales para los análisis de LC-MS porque pueden alterar la selectividad de la columna y aumentar el fondo. Se sabe que afectan a la ionización de la EM para inducir una grave supresión de iones. Además, es muy difícil eliminarlos de la columna y de otros componentes del sistema.
Aunque es bastante eficaz, el uso de un agente de bloqueo puede no ser la mejor opción para la preparación de muestras de LC-MS.
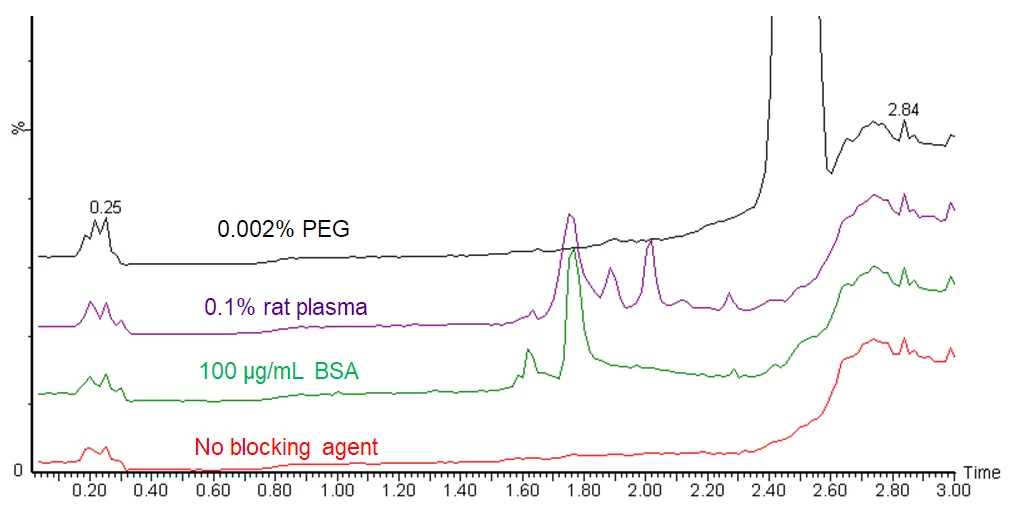
La adición de una proteína portadora es una alternativa menos problemática que el uso de detergentes y polímeros. Es una solución más favorable para las muestras de LC-MS, pero no es, sin embargo, la solución perfecta. Las proteínas pueden aparecer como picos de impurezas en los cromatogramas, véase la figura.
Se pueden evitar los picos de impurezas utilizando una monitorización de masa única o un método SRM para monitorizar sólo los analitos objetivo, pero esas impurezas pueden seguir afectando a su análisis detrás de la escena mediante la supresión o el aumento de iones. En los análisis de barrido completo, aparecen como picos adicionales en los espectros de EM, lo que complica la interpretación. Además, es más difícil manejar soluciones que contienen una alta concentración de proteínas. Al tener regiones tanto hidrofílicas como hidrofóbicas, las proteínas en solución se comportan como surfactantes. Las soluciones de proteínas forman espuma, o burbujas, con facilidad, y la formación de espuma durante el pipeteo puede dar lugar a errores de medición.
Hay algunos casos en los que es necesario un agente de bloqueo, pero es mucho más deseable si se pueden hacer muestras sin él.
Hasta ahora, hemos reflexionado sobre los problemas de la unión no específica (NSB) y los pros y los contras de los enfoques comunes para evitar la NSB. En la próxima entrada del blog, veremos cómo esta limitación afecta a su flujo de trabajo de preparación de muestras.
Esté atento a nuestra próxima entrada del blog "Preparación de la muestra antes de la cuantificación de péptidos y proteínas por LC-MS", por Kim Haynes.
Recursos adicionales:
Campo de entrenamiento en bioanálisis de péptidos y proteínas
Tarjetas de referencia de bioanálisis de péptidos Oasis
Información sobre el producto de extracción de muestras Oasis
Temas populares
ACQUITY QDa (16) bioanálisis (11) biológicos (14) biofarmacia (26) biofarmacéutica (36 ) biosimilares (11) bioterapéutica (16) estudio de caso (16) cromatografía (14) integridad de los datos (21) análisis de alimentos (12) HPLC (15) LC-MS (21 ) cromatografía líquida (LC) (19) detección de masas (15) espectrometría de masas (EM) (54 ) desarrollo de métodos (13) STEM (12)