La integridad de los datos | Invalidación injustificada de datos huérfanos

Datos huérfanos: Borrar o no borrar
En febrero de 2017 la FDA de Estados Unidos emitió una breve carta de advertencia sobre un solo tema: La invalidación (y eliminación) injustificada de datos huérfanos.
"Nuestros investigadores revisaron los registros de auditoría de varios equipos de laboratorio autónomos que usted utilizaba para realizar análisis de cromatografía líquida de alto rendimiento (HPLC) y de cromatografía de gases (GC). Nuestros investigadores descubrieron que usted había borrado secuencias cromatográficas completas e inyecciones individuales de sus ordenadores autónomos. Sin proporcionar una justificación científica, usted repitió los análisis hasta obtener resultados aceptables. No investigó los resultados originales de las pruebas que estaban fuera de las especificaciones o que eran indeseables, y sólo documentó los resultados de las pruebas que pasaban en los libros de registro y en los cuadernos de preparación. Usted se basó en estos resultados de pruebas manipulados y en registros incompletos para respaldar las decisiones de liberación de lotes."
¿Estamos haciendo la pregunta correcta?

Puede que el análisis cromatográfico no sea una ciencia exacta, pero depende en gran medida de la solidez del método original (incluida su revisión y actualización periódicas) y del rendimiento constante de un gran número de componentes individuales: Pasos de preparación de la muestra, el estándar y el disolvente, bombas, inyectores, detectores y hardware de captura de datos, temperatura del laboratorio, robustez y rendimiento de la columna, habilidades y formación del usuario, grado de automatización del proceso, las oportunidades de cometer errores manuales en la introducción de datos o en los resultados finales calculados, la claridad de los PNT, la trazabilidad (o cadena de custodia) de las preparaciones del ensayo, la habilidad -y los conocimientos- de los revisores.
Un fallo o un paso en falso en cualquiera de estos atributos contribuyentes puede acabar fácilmente en un conjunto de resultados que deben ser invalidados y repetidos. La pregunta crítica que debe hacerse es:
"Si los analistas o el personal del laboratorio trataran de invalidar resultados "indeseables", ¿el proceso de revisión distinguiría este comportamiento atroz de la corrección de errores normal esperada?"
El paso más fácil y más importante es no borrar nunca los datos huérfanos
Cualquier revisor o profesional del control de calidad tiene entonces la oportunidad de revisar los datos invalidados y juzgar si su invalidación está científicamente justificada. Pero igualmente, es clave no intentar pasar de un estado de 0% de revisión de los datos creados anteriormente y de las pistas de auditoría asociadas, a una expectativa de 100% de revisión de todos los datos y de todos los metadatos, incluyendo todas las pistas de auditoría. Aparte de la preocupación por la productividad que supone revisar cada acción de cada analista antes de aceptar un resultado como verdadero, puede ser necesario evaluar y mejorar sustancialmente las habilidades y conocimientos de los revisores en el tema que están revisando.
Pero, ¿cómo gestionamos los resultados de los datos huérfanos después de la revisión? ¿Deben los datos seguir los resultados para siempre?
Para ello, me fijo en cómo la Organización Mundial de la Salud (OMS) definió un informe de síntesis.
"Una vez que se ha completado una revisión detallada de todos los datos electrónicos, y se ha creado y revisado un Informe de Resumen que refleja con precisión todos los datos, entonces el resumen puede ser utilizado para la toma de decisiones posteriores".
Siempre que algún revisor experto haya evaluado el resumen o el conjunto de datos finales o el "informe" y esté seguro de que cualquier dato o resultado huérfano creado puede invalidarse e ignorarse científicamente, que los datos coinciden con los encontrados en los registros electrónicos y que los valores "finales" comunicados en el resumen son de confianza, a partir de este momento la información del resumen puede considerarse "oficial" y podría aprovecharse en cualquier otro requisito de información o toma de decisiones, es decir, en los informes del estudio o en los certificados de análisis.
De forma similar a la evolución de las prácticas de validación de sistemas informáticos (CSV), la industria y los reguladores tardarán en ponerse de acuerdo sobre cómo aplicar con éxito un enfoque basado en el riesgo para la "revisión de datos completos". La clave de este reto es definir qué datos deben ser revisados, en qué formato, con qué frecuencia y cómo documentar un proceso de revisión (al margen de la supervisión de los fogones clave o la grabación en vídeo de todo el proceso de análisis analítico).
Esto se aplica a todo tipo de pruebas y registro de datos, pero la dependencia de los conocimientos y la habilidad de los analistas para interpretar correctamente los datos cromatográficos hace que esta área sea clave para definir un proceso de revisión sólido frente a la aplicación de controles imposibles.
Infografía: Cumplimiento de los requisitos técnicos para la conformidad de los sistemas informáticos de laboratorio
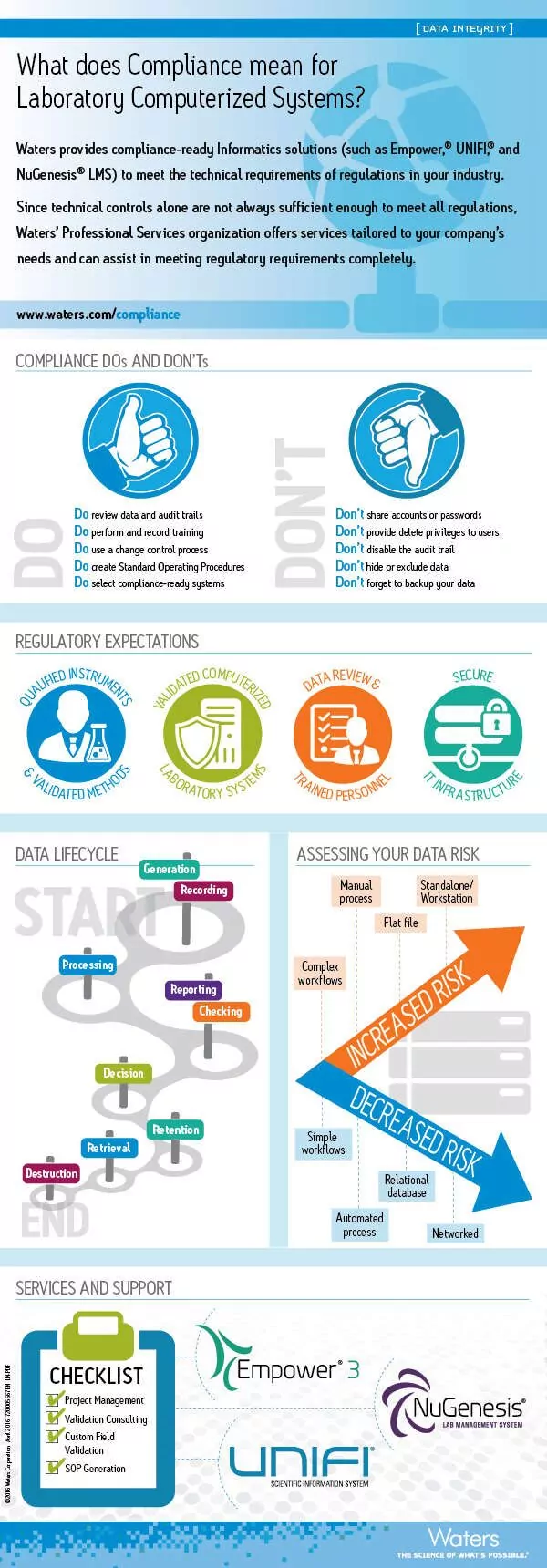
Lea más artículos en la serie de blogs de Heather Longden, Data Integrity Matters.
Más recursos:
- Seminario web a la carta: ¿Por qué los datos electrónicos de los CDS son un problema importante de integridad de los datos para los reguladores?
- ¿Qué significa el cumplimiento de la normativa para los sistemas informáticos de laboratorio? Lea nuestro libro blanco
- Más información sobre cómo garantizar la calidad mediante el cumplimiento de Waters
Temas populares
ACQUITY QDa (16) bioanálisis (11) biológicos (14) biofarmacia (26) biofarmacéutica (36 ) biosimilares (11) bioterapéutica (16) estudio de caso (16) cromatografía (14) integridad de los datos (21) análisis de alimentos (12) HPLC (15) LC-MS (21 ) cromatografía líquida (LC) (19) detección de masas (15) espectrometría de masas (EM) (54 ) desarrollo de métodos (13) STEM (12)


