Las columnas también son importantes: Cómo elegir la mejor fase estacionaria para la LC-MS de NanoFlow y Microflow

Parte 2: Consideración de las fases estacionarias para las configuraciones de trampa y eludo
En la parte 1 de esta serie, repasé algunos mecanismos básicos, ventajas y consideraciones a la hora de implementar el trapping en un flujo de trabajo proteómico. El reto volumétrico de la LC-MS de nano o microflujo y su configuración de trampa-electrodo desempeñan un papel vital a la hora de establecer la separación proteómica.
Tanto el volumen como la dirección de elución pueden provocar un ensanchamiento de las bandas, lo que puede deteriorar la cromatografía. Por eso quiero discutir aquí el impacto de la retentividad y las características de las fases estacionarias para las separaciones proteómicas en fase inversa y cómo puede utilizarlas en su beneficio.
- Parte 1: Cómo mejorar la proteómica LC-MS de nano y microflujo teniendo en cuenta la propia separación
- Parte 2: Elección de la mejor fase estacionaria para NanoFlow y Microflow LC-MS
- Parte 3: Optimización de las condiciones de captura
Las ventajas de concentrar una muestra
Comprender la retentividad de las fases estacionarias utilizadas en una configuración de trampa y elución para separaciones de péptidos le dará una ventaja significativa a la hora de optimizar su método. La diferencia de retentividad es la base de las llamadas separaciones cromatográficas.
La retentividad de los péptidos está influida por muchos factores:
- Fase móvil
- Todos los aspectos de la fase estacionaria (propiedades de la partícula base, ligando, etc.)
- Características del analito y su interacción con la fase estacionaria
En la cromatografía de fase inversa, los péptidos hidrofílicos no se retendrán muy bien en ninguna fase estacionaria C18, mientras que los péptidos hidrofóbicos serán fuertemente retenidos y eluirán más tarde en la separación. La retentividad hidrofóbica es, por tanto, el factor decisivo para separar diferentes péptidos.
Para optimizar aún más la separación y garantizar la mejor capacidad de picos de la separación LC de nanoflujo entregada al MS, debe minimizarse la dispersión de los picos. Este efecto adverso del ensanchamiento de los picos puede mitigarse mediante un "efecto de reenfoque", en el que los analitos inyectados quedan fuertemente retenidos en la entrada de la columna y forman una banda estrecha.
Para enfocar un volumen de muestra inyectado, la fase estacionaria debe ser capaz de retener los analitos de interés al inicio del gradiente. Cuando se realiza una separación por trampa y elución, la fase estacionaria de la columna analítica debe ser más retentiva que la fase estacionaria de la columna trampa para poder reenfocar. Para conocer los antecedentes de la teoría implicada, recomiendo la lectura del manual de HPLC de Waters.
Los contendientes
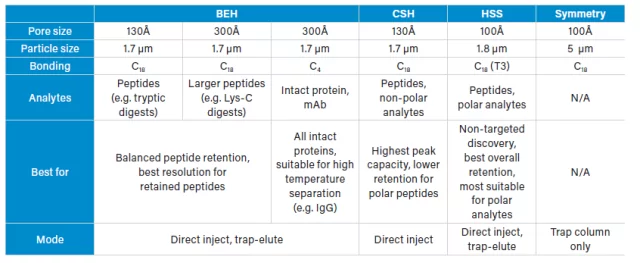
Antes de entrar de lleno en los detalles de las separaciones peptídicas y la retentividad, quiero presentar brevemente las fases estacionarias que generalmente utilizamos para las separaciones peptídicas en el bioanálisis de péptidos y en la cuantificación de péptidos y proteínas en general.
El híbrido de etileno puenteado (BEH) y el híbrido de superficie cargada (CSH) son fases estacionarias basadas en la misma partícula base. La partícula CSH tiene una carga superficial positiva, lo que le confiere propiedades diferentes para la separación de péptidos en comparación con la partícula BEH. La sílice de alta resistencia (HSS) ofrece la retentividad y selectividad de una partícula basada en la sílice para su uso a presiones más altas en las que las partículas de sílice tradicionales habrían fallado mecánicamente. Por último, existe una columna Symmetry trap basada en sílice, que también está basada en sílice.
¿Qué importancia tiene todo esto para la separación de péptidos? Sigamos.
Retención de péptidos
Hemos analizado la retentividad de los péptidos de las fases estacionarias comunes utilizadas en las columnas nanoEase M/Z y en las iKeys. Para ello, inyectamos una mezcla de péptidos en condiciones de gradiente y controlamos la cromatografía de 12 péptidos individuales. Se comparó el porcentaje de acetonitrilo necesario para eluir cada uno de los 12 péptidos y nos mostró las diferencias de retentividad de cada una de las fases.

Al observar las fases estacionarias individuales, podemos discernir la hidrofobicidad de los péptidos individuales. A primera vista, también se puede diferenciar la retentividad de las fases estacionarias individuales. Ya es un gran conjunto de datos.
Si simplificamos aún más este gráfico y promediamos el porcentaje orgánico (acetonitrilo, ACN) necesario para eluir los 12 péptidos, podemos pintar un cuadro muy sencillo pero comprensible.
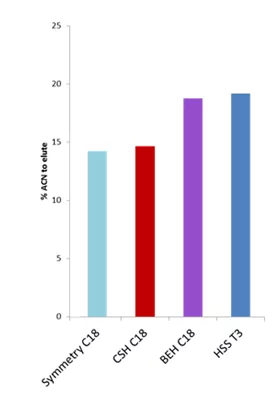
Este gráfico nos muestra que Symmetry C18, el material utilizado en las columnas trampa, muestra -en promedio- la menor retentividad de péptidos de todas las fases. BEH C18 y HSS T3 requieren aproximadamente un 5% más de acetonitrilo que Symmetry para eluir péptidos. Es una gran noticia.
Supongamos que eluimos un analito de una trampa Symmetry C18 al 15% de acetonitrilo. El mismo analito en la misma fase móvil (15% de acetonitrilo) seguirá reteniéndose en una columna nanoLC analítica BEH C18 o HSS T3 aguas abajo para beneficiarse del efecto de reenfoque. Y eso hará que haya una gran cromatografía y picos bien separados, lo que llevará a más identificaciones de proteínas y péptidos.
Pero, mirándolo bien, esto también sugiere que la CSH, una fase estacionaria con excelente capacidad de carga y forma de pico para los péptidos, puede no ser la mejor candidata para la proteómica de trampa y elución. Por eso, en general, recomiendo utilizar CSH para las separaciones de péptidos por inyección directa.
Por supuesto, nada de esto es absolutamente cierto para cada compuesto de su muestra, pero es un punto de partida fantástico a la hora de elegir la fase estacionaria adecuada para un proyecto de proteómica.
Con más detalle
En esencia, hemos comprobado que la capacidad de emparejar diferentes fases estacionarias para que se adapten mejor a las necesidades de su separación es una ventaja significativa y puede tener un impacto muy positivo en sus resultados.
Hay mucho más que decir sobre los detalles que hay detrás de esto y lo que significa para su análisis proteómico de LC-MS de nanoflujo. Mi colega Moon Chul Jung resumió todos sus hallazgos y comparaciones en un excelente libro blanco sobre la elección de la fase estacionaria adecuada para la LC-MS de nanoflujo y microflujo para la proteómica.
Además, en caso de que te lo hayas perdido, escribí un breve artículo sobre los mecanismos generales de captura, como la elusión de la trampa hacia adelante y hacia atrás.
Recursos adicionales
- Qué es el microflujo LC
- Las columnas también importan: cómo mejorar la proteómica LC-MS de nano y microflujo teniendo en cuenta la propia separación
- Microflow LC ofrece una mayor sensibilidad gracias a la reducción de los efectos de la matriz
- Nano y Micro columnas LC de Waters
- Libro blanco: Consideraciones para la selección de las fases estacionarias óptimas para la nano-cromatografía de trampa y elución proteómica
- ¿Desea una inmersión más profunda? Reproduzca nuestro reciente seminario web organizado por SelectScience, Considerations for Selecting the Optimal Stationary Phases for Proteomic Trap-and-Elute NanoLC-MS (Consideraciones para la selección de las fases estacionarias óptimas para la NanoLC-MS proteómica), con la participación de Moon Chul Jung, Ph.D., de Waters
Temas populares
ACQUITY QDa (16) bioanálisis (11) biológicos (14) biofarmacia (26) biofarmacéutica (36 ) biosimilares (11) bioterapéutica (16) estudio de caso (16) cromatografía (14) integridad de los datos (21) análisis de alimentos (12) HPLC (15) LC-MS (21 ) cromatografía líquida (LC) (19) detección de masas (15) espectrometría de masas (EM) (54 ) desarrollo de métodos (13) STEM (12)