Una visión de la industria biofarmacéutica en Asia - una entrevista con Ken Fountain
Ken Fountain, Director de Desarrollo de Negocios Biofarmacéuticos de Waters, regresó recientemente de un viaje a Asia en el que visitó a los clientes de Waters en Corea del Sur y asistió a la Cumbre Ejecutiva Biofarmacéutica de China en Shanghai, en la que Waters fue patrocinador. Nos pusimos al día con él y le pedimos que compartiera sus opiniones sobre la industria biofarmacéutica en Asia.
P: Según las conversaciones y observaciones realizadas durante su viaje, ¿qué fuerza tiene la industria biofarmacéutica en Asia?
R: Asia es un gran motor de crecimiento para las industrias farmacéutica y biofarmacéutica. En China y Corea del Sur, concretamente, la atención se centra en el desarrollo de biosimilares. Ya se han fabricado y comercializado varios medicamentos biosimilares en estos países. La región está poniendo mucho empeño en el avance de los biosimilares y otros productos biológicos.
De hecho, está ocurriendo a un ritmo tan rápido que algunas estimaciones sitúan las ventas futuras de estos biosimilares por encima de las de los genéricos de moléculas pequeñas. Algunos fármacos, como los conjugados de anticuerpos y fármacos (ADC), están siendo objeto de biosimilares a pesar de que sus patentes no expirarán hasta dentro de unos años.
También estamos viendo que muchas empresas farmacéuticas mundiales se asocian con instituciones académicas y empresas biofarmacéuticas locales en esta región. Están estableciendo centros de innovación e instalaciones de fabricación para acelerar el desarrollo y la aprobación de biosimilares, lo que también está contribuyendo al rápido crecimiento de la industria en Asia.
P: ¿Qué más ha aprendido sobre los esfuerzos de la región para hacer avanzar los biosimilares y otros productos biológicos?
R: Probablemente, el mayor debate gira en torno a la normativa. ¿Cuáles serán las directrices reglamentarias que definan la "similitud" de un biosimilar, tanto dentro de los países como en el mercado mundial? El resultado de estos debates determinará el camino reglamentario para los biosimilares producidos y comercializados para la población local frente a los producidos para su venta en Europa y América.
En China, la normativa sobre productos biológicos está cambiando muy rápidamente para ajustarse a las normas de armonización mundial. Además del trabajo sobre los biosimilares, he mencionado que hay una serie de empresas farmacéuticas mundiales y locales que se asocian para desarrollar nuevos medicamentos. Para ello, la FDA china está estableciendo una vía acelerada de revisión. Además, el gobierno chino está invirtiendo mucho en los esfuerzos de descubrimiento temprano. Los principales esfuerzos se centran en mejorar la medicina para la población china.
La industria biofarmacéutica está bastante bien establecida en Corea del Sur, con el primer biosimilar de anticuerpos del mundo, Remsima, producido por Celltrion, aprobado allí en 2013(véase la nota de aplicación de Waters relacionada). Existe una fuerte asociación entre la industria privada y el gobierno con laboratorios centrales de pruebas que proporcionan servicios de caracterización, así como servicios de validación para las nuevas tecnologías, que pueden ser adoptadas en las regulaciones.
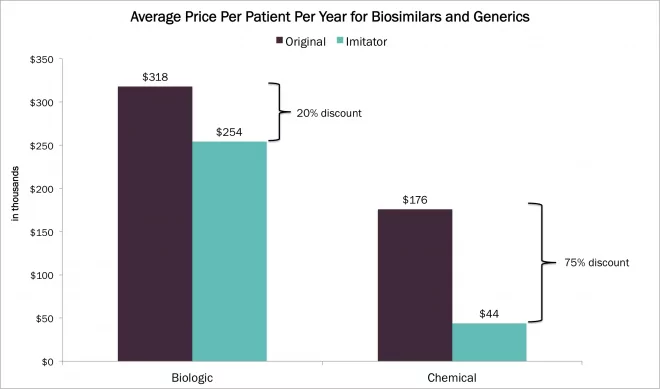
Recientemente, la coreana Samsung Biologics reveló su objetivo de convertirse en el mayor fabricante de medicamentos biológicos del mundo para 2020. Se han publicado muchos artículos sobre la última inversión de Samsung en productos biofarmacéuticos, culminada recientemente con la aprobación de su biosimilar Enbrel tanto en Corea del Sur como en Europa(véase la nota de aplicación de Waters relacionada). Estos esfuerzos podrían tener implicaciones significativas para la industria, específicamente en torno a la estructura global de precios de los medicamentos biosimilares, que actualmente se venden por aproximadamente un 25% menos que los productos de referencia.
P: ¿Cuáles son algunas de las innovaciones y avances tecnológicos más interesantes que ha visto en Asia?
R: Debido a la necesidad de una caracterización completa de los productos biológicos para demostrar su similitud con los productos de referencia(véase el seminario web de Waters relacionado), tanto Corea del Sur como China están invirtiendo en muchas de las mismas tecnologías utilizadas en las empresas farmacéuticas occidentales, a saber, cromatografía líquida, espectrometría de masas y electroforesis capilar. Esto incluye la espectrometría de masas de alta resolución para realizar una caracterización química y estructural en profundidad, que son parámetros clave para determinar la similitud de lo que están produciendo con los productos de referencia.
A medida que la industria biofarmacéutica examina detenidamente las innovaciones en materia de fabricación y diseño de instalaciones, Asia es uno de los lugares clave donde se prueban y aplican estos nuevos diseños de instalaciones.
En cuanto a la producción, el gigante biofarmacéutico Amgen abrió una planta de fabricación de un solo uso en Singapur en 2014. Estas plantas utilizan menos energía y agua en comparación con las plantas convencionales, pero producen el mismo rendimiento. Son más pequeñas, más flexibles y ahorran en costes operativos.
P: ¿Los mercados asiáticos van a influir en el desarrollo biofarmacéutico en todo el mundo?
R: Creo que el mercado asiático ya ha demostrado su importancia para la industria. Como he mencionado, varios medicamentos biológicos -muchos de los biosimilares que se comercializan actualmente- se han desarrollado y comercializado en Asia, a veces a un ritmo récord. Ese desarrollo de biosimilares se está acelerando, y Asia desempeña un papel fundamental en el impulso de los debates sobre precios y orientación normativa.
En el futuro, Asia será un actor clave como motor del desarrollo de nuevos fármacos, de las tecnologías necesarias para caracterizarlos y de los avances en la producción de biológicos y las pruebas de liberación.
P: ¿Qué está haciendo Waters en el ámbito de los biosimilares?
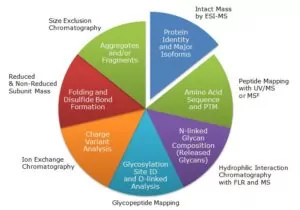
R: Waters lleva algún tiempo aplicando sus capacidades de caracterización bioterapéutica al área de los biosimilares, específicamente en lo que se refiere a la determinación de la similitud.
En la actualidad, estamos trabajando con las agencias reguladoras y los desarrolladores y fabricantes de medicamentos biosimilares para comprender el próximo conjunto de desafíos a los que se enfrentan, y cómo la tecnología de Waters puede abordar esos desafíos para ayudar a que estos medicamentos lleguen al mercado más rápidamente. Esto incluye la formación sobre qué son los biosimilares, cómo se define la similitud y qué puede hacer la LC-MS para ayudar a acelerar el desarrollo y la comercialización de los biosimilares.
En 2016, lanzaremos aplicaciones para impurezas (por ejemplo, proteínas de la célula huésped) y análisis de estructuras de orden superior en biosimilares de anticuerpos monoclonales (mAb), así como el uso de soluciones basadas en LC-MS para la evaluación de la similitud de medicamentos biosimilares que no son mAb, como la insulina y la eritropoyetina (EPO).
For more information on Waters technologies and tools for biosimilar analysis, please visit legacy-stage.waters.com/biosimilars.
Siga a Ken en Twitter: @mAb_dude
Temas populares
ACQUITY QDa (16) bioanálisis (11) biológicos (14) biofarmacia (26) biofarmacéutica (36 ) biosimilares (11) bioterapéutica (16) estudio de caso (16) cromatografía (14) integridad de los datos (21) análisis de alimentos (12) HPLC (15) LC-MS (21 ) cromatografía líquida (LC) (19) detección de masas (15) espectrometría de masas (EM) (54 ) desarrollo de métodos (13) STEM (12)


